
Химическая технология
В общеизвестной книге "Общая химическая технология" академик С. И. Вольфкович дает следующее определение: "Технология изучает методы и процессы переработки сырья в предметы потребления и средства производства". В химической технологии эти процессы сопровождаются изменением "...состава и внутренней структуры вещества, осуществляемые путем химических реакций".
При решении практических задач химической технологии исследователь вынужден часто обращаться к периодической системе элементов Д. И. Менделеева, что особенно важно в случае синтеза веществ с заданными свойствами. На примере решения двух вопросов: синтеза хладоносителей и продуктов силикатной промышленности можно рассмотреть использование периодической системы.
В связи с широким распространением бытовых холодильников необходимо было синтезировать хладоносители - вещества, которые должны обладать большой устойчивостью, не окисляться и не образовывать с воздухом взрывоопасных смесей, иметь относительно низкую температуру кипения, не взаимодействовать с металлами и не обладать ядовитым действием. Иначе говоря, была поставлена задача подобрать весьма устойчивые в химическом отношении, легко конденсирующиеся вещества.
Такие свойства должны иметь вещества, молекулы которых: не являются ионными или полярными, т. е. исключаются все соли и все вещества с несимметричными молекулами. Наибольшая симметричность характерна для молекул, образованных элементами четвертой группы с полностью насыщенными связями. Естественно было остановиться на соединениях первого представителя этой группы - углерода. Действительно, соединения состава СГ4, где Г - F, Cl, Br или I, обладали всеми заданными свойствами. Однако СВr4 и Сl4 следовало исключить, так как эти вещества твердые, относительно менее устойчивы и дороги. При сравнении свойств других двух соединений - тетрафторметана и тетрахлорметана:
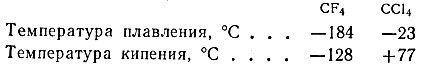
было установлено, что ССl4 - жидкость при обычных условиях, a CF4 может сжижаться лишь при очень низких температурах (-128° и ниже). Следовательно, ни то, ни другое вещество не может быть использовано в качестве хладоносителя. Если же в молекуле CF4 заместить два атома фтора на два атома хлора и получить дифтордихлорметан - CF2Cl2, то это вещество по температурам кипения и плавления должно занимать промежуточное место; в действительности температура его плавления равна -155° С, а кипения -30° С. Дифтордихлорметан относительно легко испаряется при -30° С, а теплота испарения равна 39,9 ккал/моль. Это вещество нашло широкое применение в холодильной технике и известно как фреон марки "Ф-12" (есть фреоны и других марок).
Периодической таблицей широко пользовались при подборе систем в производстве силикатов, тугоплавких фарфоров и цементов клинкерного типа.
Еще в 1931 г. проф. М. А. Безбородое выявил роль отдельных элементов в стекловарении, разделив их на пять типов (табл. 44).
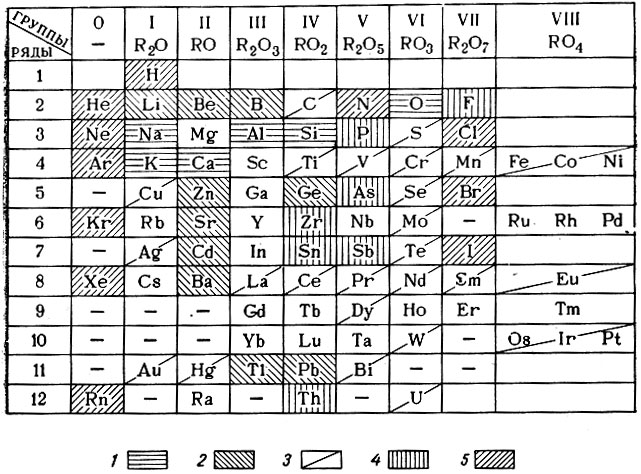
Таблица 44. Элементы, применяющиеся в стекловарении (по М. А. Безбородову)
1 - главные стеклообразующие элементы; 2 - прочие стеклообразующие элементы; 3 - красящие и обесцвечивающие элементы; 4 - глушители; 5 - элементы, не применяющиеся в стекловарении.
Было установлено, что к главным стеклообразующим элементам относятся те, которые характеризуются наибольшей распространенностью в природе (см. рис. 16).
Красящие (хромофорные) свойства элементов, как установил чл. корр. АН СССР И. Ф. Пономарев, зависят, в первую очередь, от типа элементов и размеров молекул силикатов, образуемых ими. Среди хромофоров основными являются d-элементы VI, VII, VIII и IB-групп четвертого периода (хром, марганец, Железо, кобальт, никель и медь).
Однако для производства стекла (и изделий из него) недостаточно было отыскать стеклообразующие элементы и элементы, обладающие хромофорными свойствами; надо было еще подобрать такие системы, эвтектическая смесь которых обладала бы температурой плавления, приемлемой для стекловарения. Проф. Н. В. Соломину удалось показать, что температура плавления эвтектик систем "оксид металла - кремнезем" понижается с увеличением атомного веса металла IA- и IIА-групп, входящих в состав оксида. Это объясняется усилением основных свойств оксидов щелочных и щелочноземельных металлов с возрастанием атомного веса, вследствие чего происходит ускорение процесса распада кристаллических агрегатов кремнезема и образования более легкоплавких эвтектик.
Для производства огнеупорных силикатных материалов необходимо было подобрать состав с наиболее высокой температурой плавления. Наибольшей температурой плавления должны обладать соединения с молекулой ионно-ковалентного типа, с плотной кристаллической упаковкой, а следовательно, с высокой теплотой образования. Такие окислы могли бы образовать металлы IVB-группы периодической системы. Действительно, именно металлы этой группы - Ti, Zr и Hf (электронная конфигурация d2s2) дают наиболее тугоплавкие окислы (ТiO2 - 1842 °С, ZrO2 - 2710 °С, НfO2 - 2811 °С). Они-то и нашли применение в производстве огнеупоров. Руководствуясь этим, русский инженер-силикатчик А. А. Литваковский подобрал наиболее рациональный состав огнеупорных материалов, отличающихся большой термической устойчивостью.
Эмпирически было найдено, что системы СаО с Al2O3, Fe2O3 или SiO2 обладают вяжущими свойствами. Они и нашли применение в производстве цемента. Сопоставляя свойства элементов и их соединений по группам и рядам периодической системы и учитывая, что необходимыми условиями проявления вяжущих свойств должны быть оптимальные радиусы ионов металлов (больше 1,03 А) и высокая степень основности солей, которыми и обладают силикаты, ферраты и алюминаты кальция, В. А. Кинд и В. Ф. Журавлев высказали следующее предположение. Системы, подобные системам СаО с Аl2O3, Fe2O3 или SiO2, должны давать ВеО, SrO и ВаО, т. е. оксиды элементов четных рядов II группы периодической системы, с одной стороны, и оксиды Сr2O3, Мn2O3 и GeO2 - с другой. Вскоре Журавлев получил ортогерманат и ортостаннат кальция (Ca2Ge2O4 и Ga2SnO4), которые действительно обладали вяжущими свойствами, т. е. доказал правильность ранее выдвинутых предположений.
Рассматривая вяжущие, цементирующие свойства как химические, принадлежащие большой группе соединений, сходных по своему составу и строению, и опираясь на периодическую систему элементов, Журавлев провел систематику вяжущих соединений элементов IIА- и IIВ-групп и предугадал наличие или отсутствие вяжущих свойств у еще не синтезированных соединений (табл. 45).

Таблица 45. Вяжущие свойства соединений элементов IIА- и IIB-групп (по В. Ф. Журавлеву)
* - установлены вяжущие свойства; ** - предсказаны вяжущие свойства: OO - вяжущие свойства отсутствуют; O - системы не изучены, но предполагается отсутствие вяжущих свойств.
Из таблицы следует, что оксиды металлов нечетных рядов и второго ряда II группы не образуют с указанными вторыми компонентами соединений с вяжущими свойствами (радиусы ионов металлов 1,03 А). Все изложенное относится к цементам клинкерного типа, которые получаются обжигом компонентов при высоких температурах.
Изучая цементы специального типа (зубные цементы), относящиеся к системам МеО-Р2O5-Н2O, Журавлев пришел к противоположным выводам. Вяжущие свойства присущи цементам изготовленным на основе MgO, ZnO и CdO; у СаО они проявляются весьма слабо, а у SrO и ВаО полностью отсутствуют.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'