
Изотопы и изобары
Согласно протонно-нейтронной теории ядер, изотопами называют разновидности атомов с одинаковым числом протонов и различным числом нейтронов в ядрах; изобарами - разновидности атомов с различным числом протонов и нейтронов, но одинаковым числом нуклонов. (Такие атомы следовало бы, по предложению С. А. Щукарева, называть изонуклонами, так как при одинаковом массовом числе истинные массы двух изобаров не равны друг другу.)
В 1906 г. были открыты первые радиоактивные изотопы 23090Тh и 23290Тh, в 1919 г. удалось экспериментально доказать наличие устойчивых изотопов у неона - 2010Ne и 2210Ne. С каждым годом число открытых изотопов возрастало: в 1921 г. их было известно уже 243, а в настоящее время - свыше 1500 (из которых только 272 являются устойчивыми или стабильными изотопами).
В соответствии с числом протонов, входящих в состав ядра, все элементы можно разделить на четные и нечетные по Z (Zчет и Zнечет). Так как в состав ядер входят также нейтроны, а число их равно или больше числа протонов, т. е. оно может быть также четным или нечетным, то, следовательно, и массовые числа А( = Z + N) могут принимать четные и нечетные значения. Отсюда следует, что возможны четыре варианта ядер атомов:
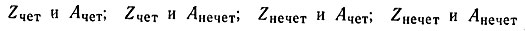
Так возникло представление о четных типах ядер. Оказалось, что наиболее устойчивыми являются ядра с Z4eT и особенно те, для которых Zчет и Ачет - это так называемые четно-четные ядра (с четным Z и четным N). Менее прочными являются ядра с Aнечет. Это четно-нечетные ядра (с четным Z и нечетным N) и нечетно-четные (с нечетным Z и четным N). Наименьшей прочностью обладают нечетно-нечетные ядра (с нечетным Z и нечетным N). Известно всего 4 устойчивых нечетно-нечетных ядра: 21Н, 63Li, 105B и 147N.
Из 42 нечетных по Z элементов (до 83-го включительно) два не имеют устойчивых изотопов (43Тс, 61Pm), четырнадцать имеют по два устойчивых изотопа, а все остальные - только по одному устойчивому изотопу, причем все устойчивые изотопы характеризуются нечетным массовым числом, кроме четырех изотопов: 2Н, 6Li, 10B и 14N. Таким образом, нечетные Z элементы являются в основном моноизотопными, состоящими из одного устойчивого изотопа.
Для 41 четного по Z элемента (до 82) известно 213 устойчивых изотопа, причем только один элемент моноизотопен (9Ве), а все остальные - полиизотопны и имеют от 2 до 10 изотопов (например, у 50Sn десять устойчивых изотопов с А = 112 ÷ 124). Элементы с четным А имеют 162 устойчивых изотопа, с нечетным - 51.
Устойчивость изотопов определяется отношением квадрата порядкового номера к массовому числу Z2/A. Если (Z2/A) > 33, то у элемента нет ни одного устойчивого изотопа. Таковыми являются элементы с Z = 84 ÷ 105; у них все изотопы радиоактивны. Последний элемент, для которого еще известен устойчивый изотоп, - это элемент с Z = 83, т. е. висмут - 20983Вi.
Для каждого отдельного элемента существует оптимальное отношение числа нейтронов к числу протонов 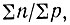
при котором возможно существование устойчивых изотопов: за пределами этого отношения при избытке протонов и недостатке нейтронов известны β+-радиоактивные изотопы, а при избытке нейтронов и недостатке протонов - β--радиоактивные изотопы. Например, для кислорода известны семь изотопов:

Природный кислород представляет собой смесь - плеяду из трех устойчивых изотопов: 168O (99,759%), 178O (0,037%) и 188O (0,204%), в которой больше всего легкого изотопа, содержащего в ядре равное число нейтронов и протонов: Σn / Σр = 8:8 = 1. Это отношение является характерным для наиболее устойчивых изотопов всех четных по Z элементов до 4020Са включительно. В ядрах изотопов последующих элементов с Z = 21 ÷ 83 в связи с возрастающим числом протонов электростатические силы отталкивания между ними увеличиваются, и ядра стабилизируются за счет "вхождения" большего числа нейтронов. Отношение Σn / Σр постепенно растет, доходя у 20983Вi до 1,518.
Из диаграммы устойчивости ядер всех изотопов (рис. 18), составленной в координатах Z - N, видно, что легкие ядра до 4020Са группируются вдоль прямой линии N = Z, отвечающей отношению Σn / Σр = 1. Для последующих ядер это отношение возрастает вследствие увеличения числа нейтронов, но остается меньше 2 (прямая N = 2Z). В вертикальном направлении расположены изотопы элементов: черными кружками обозначены - устойчивые, белыми кружками - β-- и β+3 радиоактивные.
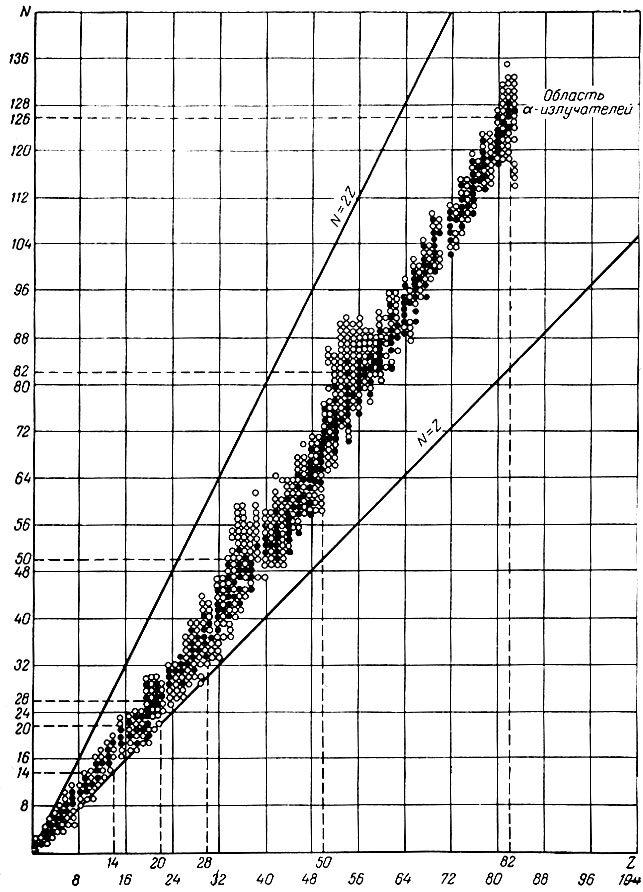
Рис. 18. Диаграмма устойчивости ядер изотопов элементов в координатах Z - N
Изотопы нередко являются изобарами различных элементов. Известны группы, состоящие из двух или трех изобаров, например:
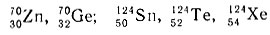
В настоящее время насчитывается 59 пар и 6 триад изобаров. В этих группах устойчивых изобаров порядковые номера отличаются на две единицы. Если встречаются изобары двух соседних элементов, отличающихся по порядковому номеру на единицу, то один из изобаров должен быть радиоактивным. Например, изотоп 9944Ru - устойчив, а его изобар 9943Тс - радиоактивен (у технеция нет устойчивых изотопов).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'