
Система изотопов (ядер)
Как было показано выше, ряд ядерных свойств, например, моменты ядер, дефект массы и устойчивость ядер, распространенность в природе, энергия присоединения к ядрам протона и нейтрона, оказались периодически изменяющимися свойствами. На кривых этих свойств в зависимости от Z, N или А имеются резко выраженные максимумы и минимумы. Последние отвечают ядрам, содержащим определенное число протонов и нейтронов. Эти числа, названные магическими, получили объяснение на основе оболочечной модели ядра, вскрывающей закономерное распределение нуклонов по ядерным уровням. Все это приводит к мысли, что устойчивые и радиоактивные изотопы должны быть связаны между собой в единой, периодической системе.
Естественная систематика изотопов или ядер должна основываться на количественных характеристиках, именно: порядковом номере Z и массовом числе А или их производных N = = A - Z, Id, Z/A и др. (N определяет число нейтронов в ядре). Ядра, содержащие одинаковое число нейтронов, называют изо-нейтронами, или, менее удачно, изотонами. Ядра с одинаковым числом избыточных нейтронов называют изодифферентами Id = A - 2Z (Id определяет число избыточных нейтронов в ядре). Величина Z/A - удельный заряд ядра, т. е. заряд, отнесенный к единице массового числа.
Сложность построения периодической системы изотопов заключается в том, что она должна охватить около 1700 разновидностей атомов, тогда как в периодической системе элементов всего лишь 105 элементов или видов атомов. Форма системы изотопов играет решающую роль. Несмотря на то что предложен ряд вариантов клеточной системы изотопов (О. Мендоза, Г. Майтак и др.), ни один из этих вариантов не является наглядным и легко воспринимаемым. Более удачны системы в виде диаграмм, графиков и схем.
В зависимости от выбранных двух основных координат варианты системы могут быть различны по построению. Принципиальная идея построения сводится к следующему: точке пересечения линий изотопов, изобаров, изонейтронов и изодифферентов должно соответствовать определенное ядро (рис. 26, а).
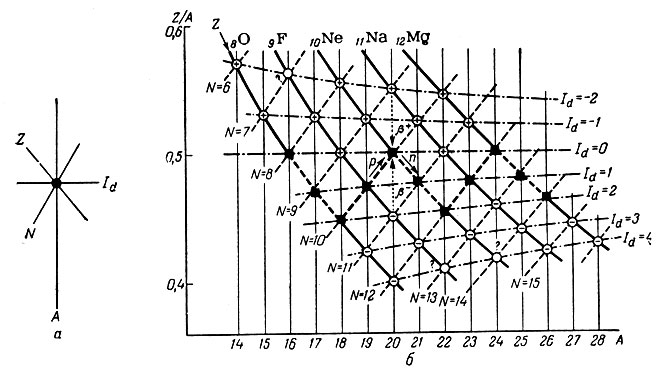
Рис. 26. Построение периодической системы изотопов химических элементов: а - принцип построения; б - часть системы в координатах Z/A - A для изотопов кислорода, фтора, неона, натрия и магния
На основе данных табл. 50 составим для изотопов пяти элементов отрезок системы (рис. 26, б) в координатах "Z/A-A". На этом графике устойчивые изотопы изображены черными квадратами, позитронные излучатели - кружком с плюсом, электронные излучатели - кружком с минусом и неизвестные до сих пор изотопы - кружком со знаком вопроса.
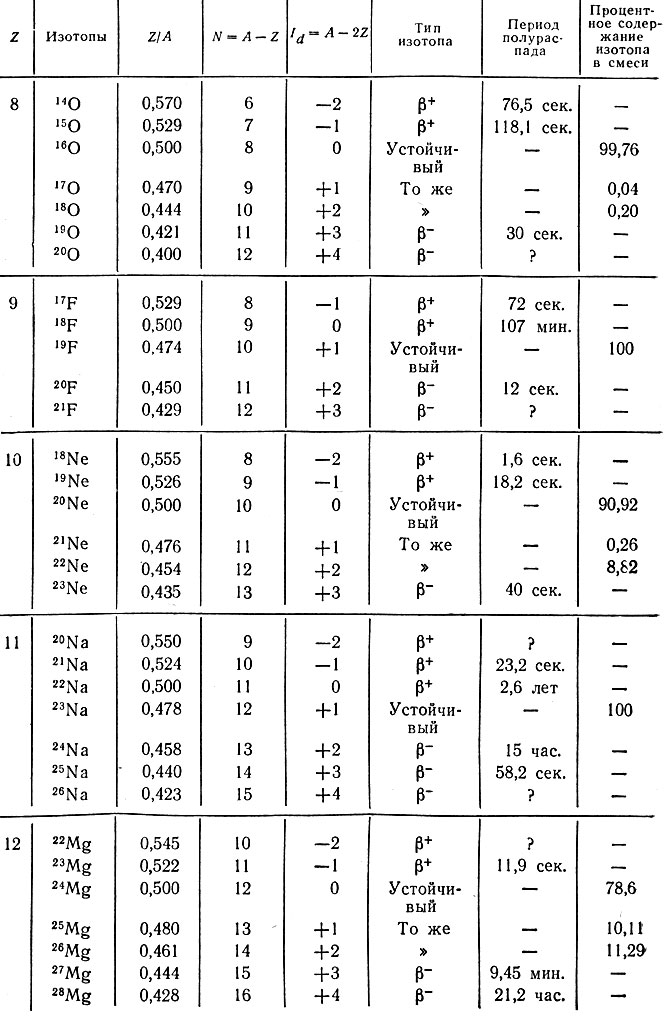
Таблица 50. Количественные характеристики изотопов кислорода, фтора, неона, натрия и магния
Каждый изотоп расположен в месте пересечения изотопной (Z), изобарной (А), изонейтронной (N) и изодифферентной (Id) линий, а так как эти числовые характеристики не могут быть дробными, то в промежутках не может находиться никаких изотопов.
Жирная пунктирная линия (см. рис. 26, б), соединяющая устойчивые изотопы, позволяет проследить последовательный генезис всех устойчивых изотопов на протяжении всей системы от 1-го до 83-го элемента. На участке системы для пяти выбранных элементов видно, что построение устойчивых изотопов следует закономерности 2n2р:
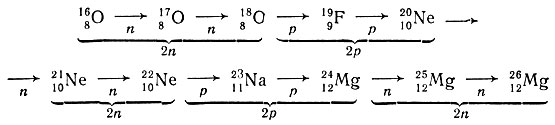
Эта закономерность приводит к тому, что у четных элементов должно быть по три устойчивых изотопа, а у нечетных - по одному, что и соответствует действительности.
Однако помимо последовательности построения ядер по типу 2n2р, возможна последовательность построения по типу 4n2р; откуда следует, что четные элементы имеют по пяти устойчивых изотопов, а нечетные - по одному. На некоторых участках системы возможно попеременное построение ядер устойчивых изотопов по типам 4n2р и 2n2р:
Так как группировки нуклонов типа 2р2n и 4n2р соответствуют ядрам изотопов гелия 42Не (2р 2n) и 62He (2р 4n), такие группировки называют гелио-группами (альфа-группами, или альфа-структурами), а само построение ядер именуют гелионным. При одинаковом значении ядра изотопов двух соседних четных 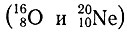
или нечетных 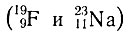
отличаются друг от друга на гелио-группу 42He и, следовательно, учет гелионного построения ядер, по-видимому, имеет немаловажное значение в систематике. Нередко отдельные ядра содержат целое число гелио-групп и числом их можно выразить состав ядра. Например, состав ядра изотопа магния 2412Mg можно выразить в виде 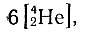
или 6α.
Область, лежащая выше жирной пунктирной кривой (рис. 26, б), занята позитронными, или β+-излучателями, а ниже - электронными, или β--излучателями. Так как места пересечения всех линий заняты радиоактивными изотопами, то следует считать, что все устойчивые изотопы данных элементов открыты и в будущем возможно искусственное получение только радиоактивных изотопов. В рассматриваемом участке системы остаются неизвестными изотопы 169F, 229F и 2410Ne (см. рис. 26, б). Нетрудно предсказать, что первый из этих изотопов должен быть β+-, а два последних - β--радиоактивными; периоды полураспада их должны быть небольшими и измеряться секундами или долями их, что следует из величин периодов полураспада соседних изотопов (см. табл. 50).
Взаимный генезис ядер по любому из четырех направлений легко прослеживается по данному участку системы. По линии Z имеет место нейтронный генезис, эта линия связывает изотопы данного элемента. В этом аспекте элементом следует называть плеяду изотопов с закономерно изменяющейся массой ядра определенного заряда.
Перемещению по вертикали, т. е. по линии А, отвечает изобарный переход, сопровождающийся в верхней части системы β+-излучением, а в нижней части - β--излучением (на рис. 26, б эти переходы отмечены пунктиром со стрелками).
По изонейтронным линиям (снизу вверх) протекает протонный генезис: переход к последующему ядру возможен при присоединении протона.
Каждое последующее ядро возникает из предыдущего, лежащего на одной изодифференте, при присоединении частицы 21H (ядро тяжелого изотопа водорода - дейтерия).
Теперь предстоит рассмотреть не участок системы, а всю систему в целом. Основные координаты можно выбрать любые. Попытки ряда ученых построить периодическую систему изотопов на основе периодической системы элементов не увенчались успехом, так как построение электронной оболочки атомов и ядерных уровней подчиняется разным закономерностям, а следовательно, длины периодов и конструкция системы в целом не могут повторять друг друга.
Несомненно, что ядерные периоды в системе изотопов должны заканчиваться ядрами с магическими числами, и в первую очередь - дважды магическими числами, отличающимися, как было показано выше, особыми свойствами. Напомним, что к этим ядрам относятся:
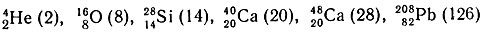
Однако между ядрами с зарядами 20 и 82 лежит значительный интервал; между ними расположены ядра изотопов с магическим числом 50. Дважды магических ядер, отвечающих этому числу, нет, и поэтому встал вопрос о конструкции периода с магическим числом 50 либо по числу протонов, либо по числу нейтронов. Выбор ядра по числу протонов однозначен - это изотоп олова 50Sn. К ядрам, магическим по числу нейтронов (50n), относятся:
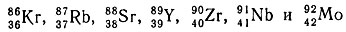
Из данных изотопов следует исключить все нечетные ядра, которые, как известно, менее устойчивы; останутся четыре четных изотопа. Неоднозначность выбора изотопов привела к тому, что в одних системах ядерные периоды заканчиваются магическими ядрами по числу протонов, в других - магическими ядрами по числу нейтронов, а в некоторых - обоими типами ядер. Таким образом, число вариантов периодической системы изотопов велико. Ниже приведено шесть вариантов периодической системы изотопов (табл. 51), в которых изотопы расположены по периодам. Вверху указаны магические числа по N, а внизу - по Z; римскими цифрами - номера периодов, а вертикальными линиями - границы периодов.

Таблица 51. Шесть вариантов периодической системы изотопов
В вариантах № 1-4 не учитывается число 28, так как авторы этих систем не считают его, так же как и число 14, магическим.
Число периодов в различных вариантах, считая последний период незаконченным, колеблется от 5 до 7, так как однозначного мнения в отношении конструкции периодической системы изотопов пока нет. Сдвиги границ периодов от магических чисел влево или вправо не имеют достаточно убедительных обоснований.
Однозначное решение вопроса о периодической системе изотопов затрудняется тем, что периодические свойства ядер проявляются не так отчетливо, как у атомов. В отличие от кулоновских сил, действующих в атоме в целом, внутри ядра действуют ядерные силы, природа которых еще не раскрыта, и потому внутриядерные свойства не всегда можно объяснить.
В качестве примера рассмотрим вариант периодической системы, составленный советским физиком И. П. Селиновым (табл. 52). Этот вариант был помещен в ряде журналов, монографий и справочников, а в 1962 г. был издан в виде настенной таблицы в красках. График системы изотопов построен в координатах "Z - Id". Устойчивые изотопы изображены черными квадратами, соединенными прямыми линиями. Образующаяся в целом зигзагообразная линия характеризует тип построения ядер (2р2n; 2р4n).
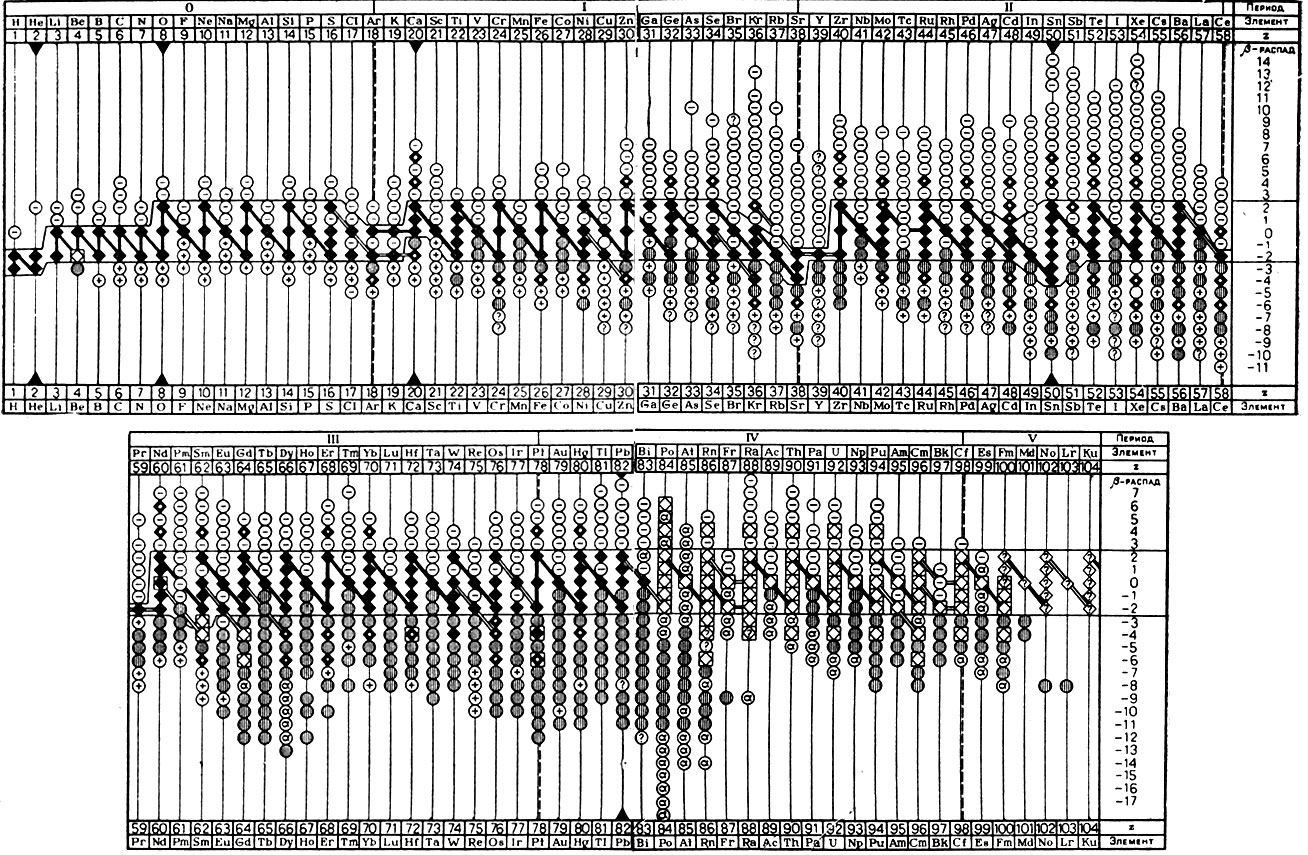
Таблица 52. Периодическая система изотопов И. П. Селинова
Над жирной линией лежит область β--, а под ней β+-радиоактивных изотопов. Каждый из этих изотопов изображен кружком со знаком + или - (в оригинале кружки окрашены в голубой и розовый цвета с указанием внутри их величин периода полураспада*). Кружками с вертикальной штриховкой отмечены радиоактивные изотопы, характеризующиеся E-захватом электронов (E-захват электрона ядром приводит к возникновению изобара с зарядом на единицу меньше). Альфа-излучатели изображены незачерненными квадратами, обрамленными тонкими линиями. Зигзагообразная линия сверху и снизу отделена двумя тонкими прямыми линиями, за пределами которых встречаются 2β-радиоактивные изотопы, т. е. изотопы, излучающие по два позитрона или электрона.
* (Используя в оригинале семь различных цветов, И. П. Селинов смог изобразить изотопы, характеризующиеся смешанным типом излучения, изомерным переходом, спонтанным распадом и другими свойствами.)
Так как после 83-го элемента нет ни одного устойчивого изотопа, черные квадраты альфа-радиоактивных изотопов в таблице Селинова заменены белыми. Короткоживущие альфа-излучатели обозначены кружками с буквой α. Если для вводимого в таблицу изотопа тип радиоактивного распада и период полураспада достоверно не установлены, то в центре кружка ставится знак вопроса. Устойчивые изотопы, выходящие за пределы 2β-устойчивых изотопов, обозначены черными квадратами с белыми просветами. Вертикальные линии, оканчивающиеся вверху и внизу черными треугольниками, отвечают изотопам магических ядер по числу протонов.
Не входя в обсуждение данного варианта по существу, отметим, что это один из многих возможных вариантов периодической системы изотопов.
Существует несколько формулировок периодического закона в ядерном аспекте. Приведем одну из них: с увеличением числа структурных элементов - нуклонов, а также возможно гелионов (в ядре) и электронов (в атомной оболочке) - периодически повторяются аналогичные особенности в строении и свойствах как ядер, так и атомов, причем эти особенности и периодичность у ядер и атомов имеют различный характер, хотя и обладают рядом сходных черт.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'