
Искусственное получение трансурановых элементов
Несмотря на то что Д. И. Менделеев указал на возможность существования более тяжелых элементов, чем уран, до 1940 г. получить их никому не удавалось. За последние 31 год, благодаря исключительному развитию техники ядерных реакций, были искусственно получены новые 13 элементов с порядковыми, номерами от 93 до 105, названные трансурановыми элементами.
Чтобы осуществить ядерную реакцию, ядра исходного элемента, или "мишени", подвергают бомбардировке различными "снарядами" (нейтронами, альфа-частицами, легкими ядрами и др.)" обладающими необходимым запасом энергии. Превращение одних ядер в другие сводится к изменению их заряда. Так как нейтроны не имеют электрического заряда, то их внедрение в "мишень" приведет к получению изотопа исходного элемента. Однако новый изотоп, содержащий большее число нейтронов, может оказаться β-радиоактивным и, излучая электрон, превратится в изотоп элемента с зарядом ядра на единицу больше.
В 1940 г. Макмиллану и Эйблсону (в США) бомбардировкой урана нейтронами удалось получить изотоп нового элемента - нептуния:

В настоящее время известно 12 изотопов нептуния с массовыми числами от 231 до 241; все они радиоактивны. Наиболее устойчивый из них - изотоп 237Np с периодом полураспада 2,2·106 лет; в земной коре его практически нет, так как период полураспада его примерно в две тысячи раз меньше возраста нашей планеты - Земли. До получения нептуния некоторые ученые предполагали, что он должен быть химическим аналогом рения и занимать место в VIIB-группе, но оказалось, что по совокупности свойств он ближе к урану.
Изотоп нептуния 237Np - родоначальник радиоактивного семейства, все члены которого по их массовым числам относятся к типу 4n + 1. Все они характеризуются малыми периодами полураспада ("вымершее семейство"). Конечным продуктом распада является устойчивый изотоп 20983Вi с магическим числом 126 (209 - 83 = 126).
При β--распаде изотопа 23993Np получается изотоп следующего элемента - плутония 23994Pu, с периодом полураспада 24400 лет. Этот изотоп можно получить также из изотопа 23892U, если добиться увеличения заряда на две единицы, но для этого в качестве ядерных "снарядов" следует использовать альфа-частицы:
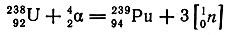
Искусственное получение 23994Pu в больших количествах имеет важное техническое значение, так как ядра этого изотопа, подобно ядрам 23592U, при воздействии медленных нейтронов претерпевают деление с освобождением значительного количества энергии. Это позволяет использовать плутоний в атомных реакторах в качестве ядерного горючего.
Ускоренные альфа-частицы с энергией 100 Мэв были использованы для получения изотопов 96, 97, 98 и 101 элементов. Этим методом синтезировали изотоп 101-го элемента, получившего название менделевий (точнее было бы - менделеевий, - B. C.) в честь творца периодической системы - Д. И. Менделеева:
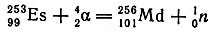
Следует отметить, что этот изотоп был получен всего лишь в количестве 17 (!) ядер. Несмотря на то что период полураспада 256101Md составляет только 30 мин, его удалось выделить и изучить свойства. Это свидетельствует о высоком уровне современного эксперимента. Естественно, что менделевий не может быть использован в качестве исходной мишени для получения ядер последующих элементов.
Для получения изотопов 102-, 103 и 104-го элементов пользовались ядрами плутония 94Pu. Чтобы увеличить заряд соответственно на 8, 9 и 10 единиц, в качестве "снарядов" были применены ионы легких изотопов кислорода, фтора и неона, ускоренные до больших энергий в циклотронах. Например, изотопы 102 и 104-го элементов были получены в лаборатории ядерных исследований в Дубне*, руководимой академиком Г. Н. Флеровым:

* (Факт получения в 1957-1961 г. 102 и 103-го элементов не подтвердился, а потому названия "нобелий" и "лоуренсий" оспариваются. Физика социалистических стран предложила для этих элементов названия "жолий" и "резерфордий".)
"Синтез" 104-го элемента представлял значительный интерес для решения вопроса о структуре 7-го периода, так как согласно актиноидной гипотезе Сиборга элемент 104 должен быть аналогом гафния.

Глен Теодор Сиборг (р. 1912)
Изучение природы 104-го элемента курчатовия было весьма затруднительно, так как было получено всего лишь 150 ядер изотопа 260104Кu, отличающегося крайней неустойчивостью (период полураспада - всего 0,3 сек. (!)). Два года потребовалось советским и чешским ученым, работающим в Объединенном институте ядерных исследований в Дубне, для доказательства, что курчатовий является химическим аналогом гафния, т. е. относится к d-элементам IVB-группы. Следовательно, 103-м элементом заканчивается семейство актиноидов, состоящее из 14 f-элементов; актиноидная гипотеза Сиборга получила блестящее подтверждение. Следует отметить, что большинство актиноидных элементов было получено в США Сиборгом и его сотрудниками (табл. 48).
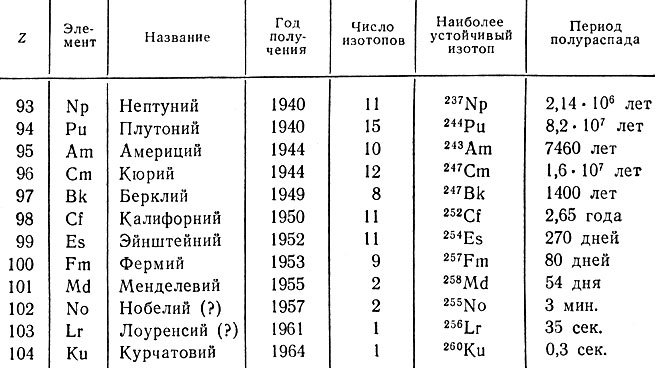
Таблица 48. Трансурановые элементы (Z = 93÷104)
В 1967 г. академику Г. Н. Флерову с сотрудниками впервые удалось искусственно получить 105-й элемент бомбардировкой изотопов америция ускоренными ионами неона:
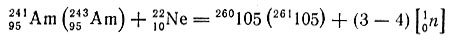
В начале 1970 г. были проведены дополнительные опыты по получению 105-го элемента и изучению альфа-активности и спонтанного распада выделенного изотопа. Установлен период полураспада, равный около 2 сек, и определена энергия альфа-излучения 8,9 и 9,1 Мэв. Химически этот элемент был идентифицирован по относительно легкой летучести его пентахлорида; он является аналогом тантала с подобной электронной конфигурацией d3s2 и должен занять место в VB-группе до 1970 г этому элементу не было дано название.
В апреле 1970 г. Гиорсо (США) сообщил, что ему с сотрудниками удалось получить элемент 105 по ядерной реакции:
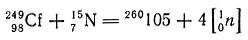
Установлено, что изотоп 260105 имеет период полураспада 1,6±0,3 сек и распадается с испусканием α-частиц с энергиями 9,06; 9,10 и 9,14 Мэв. Этому новому элементу было предложено название ганий (символ На) в честь известного немецкого радиохимика О. Гана. Г. Н. Флеров в печати указал на поспешность присвоения новому элементу названия, предложенного американскими учеными, так как приоритет в получении элемента принадлежит советским ученым, которые предложили 105-й элемент назвать нильсборий или нильсий (символ Ns) в честь крупнейшего физика Нильса Бора.
Что можно сказать о получении элементов с порядковыми номерами более 105? В области радиоактивных элементов начиная с урана, с возрастанием Z период полураспада (T1/2) спонтанного деления ядер резко снижается (например, для 23692U T1/2 = 2·1016 лет, для 29494Рu - 7,2·1010 лет, для 24896Сm - 4·106 лет, а для 105-го элемента около 2 сек., что связано с уменьшением прочности ядер. По-видимому, для изотопов элементов 106, 107 и последующих периоды полураспада будут еще меньшими и станут исчисляться долями секунды. Эти ядра должны характеризоваться большой неустойчивостью и получение и изучение их свойств вряд ли реально*. Но можно предположить, что в "море ядерной неустойчивости" имеются "острова устойчивости", на которых располагаются хотя и радиоактивные, но относительно устойчивые ядра.
* (В настоящее время в г. Дубне ведутся работы по получению элемента 106.)

Георгий Николаевич Флеров (р. 1913)
Как уже отмечалось выше, в результате теоретических расчетов были выявлены новые магические числа 114 и 126 (по Z) и 184 (по N). Дважды магические ядра 298114 (Z = 114 и N = 184) и 310126 (Z = 126 и N = 184) по расчетным данным должны относиться к сравнительно "устойчивым" с периодами полураспада до 106-107 лет. Это позволит выделить эти ядра и изучить их химические и радиоактивные свойства. Не исключена возможность синтеза ядер с Z = 114 с меньшим или большим числом нейтронов, чем 184 (N = 174÷194, а массовые числа таких ядер будут иметь значения от 288 до 308).
Синтез указанных ядер может быть осуществлен следующими ядерными реакциями:

Возможен и другой путь: слияние двух ускоренных ядер урана и последующее спонтанное деление образовавшегося сложного ядра
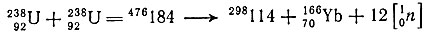
Для разработки метода химического отделения 114-го элемента от мишени и побочных продуктов других ядер необходимо знать природу этого, пока неизвестного, элемента. Здесь на помощь приходит периодическая система Менделеева. Так как порядковые номера элементов 7-го периода отличаются на 32 единицы от элементов-аналогов 6-го периода, то по разности 114 - 32 = 82 находим, что 114 элемент должен являться аналогом 82-го элемента свинца и его можно предварительно назвать экасвинцом (ЕРb). На основании местоположения 114-го элемента в системе (группа IVA) можно предсказать с относительной достоверностью все его химические свойства и электронную конфигурацию атома.
Электронная оболочка атома ЕРb должна состоять из семи уровней, а электронная конфигурация внешнего уровня отвечать типу s2p2 и, следовательно, максимальная валентность этого элемента будет равна 4. Соединения четырехвалентного эка-свинца будут неустойчивы, с сильновыраженными окислительными свойствами и будут легко переходить в двухвалентные соединения. Аналогично сульфату свинца PbSO4, сульфат 114-го элемента EPbSO4 должен быть нерастворим в воде и в виде этого соединения он может быть выделен из раствора. Малорастворимый иодид экасвинца ЕРbI2 будет взаимодействовать с избытком иодида калия, образуя растворимое комплексное соединение состава К2[ЕРbI4] или К4[ЕРbI6]. Гидроксид экасвинца ЕРb(ОН)2 должен обладать слабовыраженными амфотерными свойствами, но с преобладанием основных свойств и т. п.
Предполагаемая относительно большая "устойчивость" ядер элемента 114 и ядер, располагающихся в периодической системе по соседству с ним, подтверждается исследованием космических лучей. Английским профессором Поуэллу и Фаулеру, исследовавшим фотоснимки космических лучей, полученные на высоте 40 км над поверхностью земли (фотопластинки поднимались на эту высоту с помощью шара-зонда), удалось расшифровать треки (следы) частиц космических лучей, различающиеся своей толщиной. (Толщина треков пропорциональна массам и зарядам частиц.) Наряду с треками ядер железа (Z = 26) были обнаружены следы, толщина которых соответствует ядрам с зарядом, равным около 108. Не исключена возможность обнаружения треков, относящихся к изотопам элемента 114. Так как лучи из далекого космоса достигают района земли через миллионы лет, то, следовательно, период полураспада ядер 114-го элемента не может быть меньше этого значения, иначе они бы распались на "пути своего следования".
Естественно поставить вопрос о возможности "приземления" этих ядер на поверхность нашей планеты. Ядра 114-го элемента попадают на поверхность земли, но, как показывают расчеты, на каждый 1 кв. км "опускается" в год лишь одно ядро (!). Всего за год на всю поверхность нашей планеты "осаждается" 20 микрограммов 114-го элемента. Можно ли "собрать" такие ничтожные количества? Единственный путь, приводящий к реальному обладанию 114-м элементом, искусственное получение его ядерными реакциями, указанными выше, или другими возможными реакциями.
Менее вероятно, но возможно искусственное получение 126-го элемента. Если исходить из ториевой мишени (для тория Z = 90), то заряд следует увеличить на 36 единиц (90 + 36 = 126), а для этого в качестве "снаряда" следует воспользоваться ускоренными ионами криптона (Z = 36). Ядерная реакция будет соответствовать следующему уравнению:
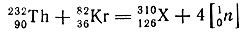
При этой реакции будет получено "дважды магическое" ядро 126-го элемента с числом нейтронов 184 (310 - 126 = 184).
Интерес к этому элементу огромен, так как его атом по структуре электронной оболочки должен относиться к новому типу 5d-элементов (напомним, что до сих пор нам были известны четыре типа элементов s-, p-, d- и f-). Этот элемент не имеет в периодической системе вышестоящих аналогов, а потому предложить ему название с приставкой эка нельзя. Пока, в соответствии с предложением чл. корр. АН СССР В. И. Гольданского, мы можем элемент 126 отнести к семейству "октадеканидов" (так названа им группировка из 18 5d-элементов 8-го периода). Поскольку данный элемент будет расположен в 8-м периоде, то электронная оболочка его атома будет состоять из восьми уровней. Конфигурация валентных электронов атома этого элемента будет 5g46f28s2 или 5g56f18s2 (по Б. И. Гольданскому - 5g68s2). По числу внешних электронов (8s2) этому элементу будет свойствен явно выраженный металлический характер. Помимо двух внешних электронов в химических реакциях будет участвовать один или несколько электронов из 5g- (или 6f-) подуровня, а потому его наиболее устойчивая форма валентности достигнет 3 или 4, хотя возможны и высшие формы валентности.
В будущих 8- и 9-м периодах должно содержаться по 50 элементов (2·52 = 50) и среди них по 18 элементов g-типа. В настоящее время уже известны таблицы периодической системы (В. И. Гольданского, М. Таубе, Г. Сиборга), включающие пока гипотетические 8-й и 9-й периоды. В качестве примера приведена (табл. 49) 9-периодная форма системы, разработанная на основе длиннопериодного варианта.
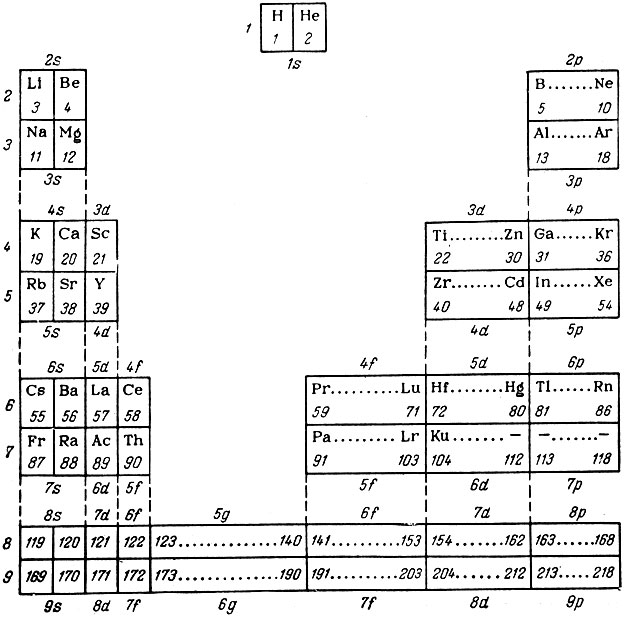
Таблица 49. Девятипериодная форма системы элементов Д. И. Менделеева
В таблице элементы-аналоги, относящиеся к одному типу, располагаются друг под другом. Как следует из таблицы, 5g-элементы не имеют аналогов.
Из сказанного о элементах 114 и 126 видно, сколь мощным орудием исследования является периодический закон и система элементов Д. И. Менделеева в наши дни.
В последние 50 лет* осуществлена мечта Фарадея, высказанная им еще в 30-х годах прошлого столетия - "Одной из ближайших задач химии явится трансмутация элементов (т. е. их взаимное превращение)". О значении решения этой задачи говорил еще Д. И. Менделеев:
* (Первая ядерная реакция была осуществлена Резерфордом в 1919 г.)
"Мне было бы интересно присутствовать при опытах превращения элементов, ибо тогда я мог бы надеяться, что будет понята истинная причина периодического закона".
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'