
14.5. Критика понятия электронного дефицита
Во всех рассмотренных молекулах электронный дефицит возникал только потому, что все связи между атомами считаются двухэлектронными. Более строгий подход в каждом случае обнаруживал, что никакого электронного дефицита в смысле наличия незанятых связывающих орбиталей нет. Во всех этих молекулах как раз достаточно электронов, чтобы заполнить все связывающие орбитали. Любая молекула, в которой имеются незанятые связывающие орбитали, была бы сильным окислителем, а это отнюдь не является свойством рассмотренных молекул.
Всегда можно избавиться от электронного дефицита, по крайней мере гипотетическим введением ионных структур. Например, диборан не будет иметь электронного дефицита в модели "протонированной двойной связи";
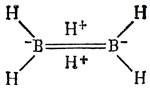
Если бы эта структура вообще была близка к истинной, то диборан был бы сильной двухосновной кислотой; на самом деле он не обладает кислотными свойствами. Наблюдается и обратная картина: ионные кристаллы не относятся к соединениям с электронным дефицитом, так как при их рассмотрении вовсе пренебрегают ковалентным вкладом в связь.
Итак, необходимым условием того, чтобы молекулу можно было отнести к классу соединений с электронным дефицитом, является возможность объяснения ее структуры только посредством делокализованных МО. Обычно удается достаточно хорошо описывать такие молекулы, пользуясь только трехцентровыми орбиталями, хотя степень делокализации МО может быть и большей.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'