
§ 5. Свойства ионов
Как многие новые смелые идеи, теория электролитической диссоциации была встречена некоторыми современниками недоверчиво. Они отказывались верить, что когда мы растворяем поваренную соль, например солим ею суп, то в растворе натрий и хлор разъединяются. Ведь известно, что представляют собой свободный натрий и свободный хлор. Свободный натрий "растворяется" в воде с выделением водорода, а при растворении поваренной соли водород не выделяется. Свободный хлор ядовит, а посоленная пища ничего, кроме пользы, нашему организму не приносит. Но свободный натрий - это незаряженные атомы натрия Na, свободный хлор - это молекулы хлора Сl2. Раствор же поваренной соли содержит не атомы натрия, а ионы натрия Na+, не молекулы хлора, а ионы хлора Сl-.
Химическая активность свободного натрия определяется наличием в его атомах валентного электрона, от которого атом натрия освобождается, реагируя с водой с выделением водорода и обращаясь в ион Na+. Поваренная соль же содержит натрий в виде готовых ионов Na+, которые лишь переходят из кристаллической решетки в раствор.
Химическая активность свободного хлора, в частности его ядовитость, связана, наоборот, с недостачей одного электрона во внешнем электронном слое атома хлора до его завершения. В ионах же хлора, содержащихся в кристаллах поваренной соли и в ее растворе, эта недостача уже восполнена. Поэтому химические свойства ионов хлора совсем иные, чем свойства свободного хлора: ионы хлора Сl-, в отличие от молекул хлора, бесцветны, лишены всякого запаха и неядовиты. Поэтому и раствор поваренной соли, в котором содержатся ионы Сl- вместе с ионами Na+, бесцветен, лишен запаха и неядовит. Более того, ионы хлора и ионы натрия необходимы нашему организму; это и заставляет нас прибавлять в пищу поваренную соль.
Различие в свойствах атомов и ионов одного и того же элемента обусловлено, таким образом, различием в строении тех и других. Гидратированные ионы Na+, К+, Сl-, NO3-, SO42- бесцветны. Поэтому бесцветны и растворы солей NaCl, KCl, NaNO3, KNO3, Na2SO4. Существуют и окрашенные ионы. Любая растворимая соль меди (с бесцветными ионами кислотного остатка) при растворении в достаточно большом количестве воды образует растворы совершенно одинакового голубого цвета. Носителями этой голубой окраски являются, очевидно, гидратированные ионы меди Сu2+. Примером окрашенного отрицательно заряженного иона служит ион кислотного остатка хромовой кислоты (Н2СrO4), он желтого цвета. Ионы СrO42- и придают желтую окраску растворам солей хромовой кислоты, например К2СrO4.
Солями с окрашенными ионами можно воспользоваться для доказательства наличия у ионов электрических зарядов. Если набросать крупинки окрашенной соли, например СuСl2 или К2СrO4, на фильтровальную бумагу, смоченную раствором какого-нибудь бесцветного электролита, крупинки будут растворяться и вокруг каждой из них на бумажке образуется окрашенное круглое пятно. Но если перед тем, как бросить крупинки соли, мы опустим на бумажку два электрода в виде загнутых проволочек, присоединенных один к положительному, а другой к отрицательному полюсу аккумулятора (рис. 4), то картина получится иная. Вместо круглого пятнышка от каждой крупинки потянется окрашенный язычок по направлению к отрицательно заряженному электроду, если окрашены положительно заряженные ионы соли, или по направлению к положительному электроду, если окраску раствору придают отрицательно заряжённые ионы.
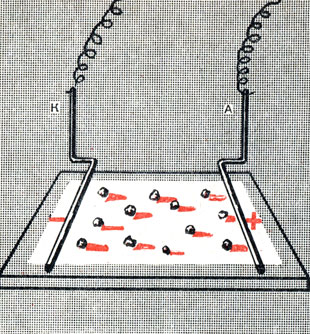
Рис. 4. Движение ионов в электрическом поле
Перемещение ионов к отрицательно заряженному электроду - катоду - и к положительно заряженному электроду - аноду - происходит вследствие притяжения соответствующих ионов электродами.

Так как положительно заряженные ионы притягиваются к катоду, они называются катионами, а отрицательно заряженные ионы, притягивающиеся к аноду,- анионами.

- Сопоставьте свойства свободного иода и ионов иода. Объясните разницу.
- "Марганцовка", раствор которой применяют для дезинфекции ран,- калийная соль марганцовой кислоты НMnO4. Что обусловливает малиновую окраску этого раствора?
- Как доказать, что ионы имеют положительный (отрицательный) заряд, если они окрашены?
- *При опыте, изображенном на рисунке 4, от кристаллика какого-то вещества потянулся красный язычок по направлению к аноду и зеленый язычок - к катоду. Что можно отсюда заключить об исследуемом веществе*?
- Какие из нижеперечисленных ионов являются катионами и какие анионами: Сl-, К+, Са2+, ОН-, SO42-? Есть ли среди них окрашенные ионы?
* (На задачи, обозначенные звездочками, ответы помещены в конце книги.)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'