
§ 6. Степень электролитической диссоциации. Сильные и слабые электролиты
Узнав, что электролиты в водном растворе диссоциируют на ионы, мы, естественно, задаемся вопросом: все ли молекулы электролита расщеплены на ионы или в растворе присутствуют и нерасщепленные молекулы? Проще всего ответить на этот вопрос, изучая растворы таких электролитов, молекулы которых окрашены иначе, чем ионы.
Безводный хлорид меди (II) СuСl2 желтого цвета. Желтую окраску имеют и растворы этой соли в таких растворителях, в которых диссоциации не происходит, поэтому носителями окраски могут быть только молекулы СuСl2. В водном растворе эти молекулы должны диссоциировать на ионы меди и ионы хлора:
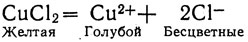
Ионы хлора бесцветны, а гидратированные ионы меди имеют голубую окраску. Значит, если хлорид меди (II) в водном растворе диссоциирует нацело и молекул его не остается, желтая окраска молекул при растворении должна смениться на голубую окраску ионов Сu2+. Если же диссоциация неполная и часть молекул не распалась, раствор будет зеленым. (Как известно, при смешивании голубой и желтой красок получается зеленая.)
Концентрированные растворы хлорида меди (II) имеют зеленую окраску. Значит, диссоциация соли в них неполная, часть молекул остается нерасщепленной на ионы.
Почему же в одном и том же растворе одни молекулы расщеплены, а другие нет? Ведь прочность химической связи между ионами во всех молекулах СuСl2 одна и та же. Очевидно, электролитическая диссоциация - процесс обратимый. Молекулы все время распадаются на ионы, а ионы противоположного знака (ионы меди и ионы хлора), встречаясь в растворе, притягиваются друг к другу и вновь образуют молекулы СuСl2. Электролитическая диссоциация относится к обратимым химическим реакциям. Чтобы отметить эту особенность процессов электролитической диссоциации (когда это нужно подчеркнуть), в уравнениях знак равенства заменяют знаком обратимости:
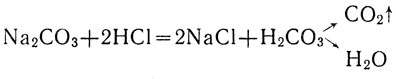
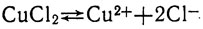
Количественно степень равновесного распада данного электролита в данном растворе на ионы оценивается степенью диссоциации.

Степень диссоциации а - это отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул.
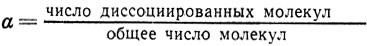
Если степень диссоциации электролита в каком-либо растворе равна, например, 1/4, это значит, что из каждых 4 молекул электролита распалась на ионы лишь одна; а 3 не расщеплены. Степень диссоциации выражают в долях от единицы, и тогда она изменяется от 0 (если диссоциации нет) до 1 (когда диссоциация полная), или в процентах (от 0 до 100%).
Как изменяется степень диссоциации раствора электролита с изменением его концентрации? Будем разбавлять концентрированный раствор хлорида меди (II) водой, прибавляя ее порцию за порцией и наблюдая, как изменяется окраска раствора. С каждой порцией воды раствор все более голубеет и при достаточно большом разбавлении становится чисто-голубым - желтых молекул СuСl2 практически в нем не остается. Наоборот, если раствор концентрировать, выпаривая из него воду, то он зеленеет.
Степень диссоциации в растворах электролитов всегда увеличивается с уменьшением концентрации электролита, т. е. по мере разбавления раствора, потому что при этом ионы все более отдаляются друг от друга и возможность им встречаться и вновь связываться в молекулы уменьшается.
Безводная уксусная кислота при испытании известным нам прибором электрического тока не проводит; ионы в ней отсутствуют. При прибавлении к ней, порция за порцией, воды лампочка начинает светиться и светится все более ярко: ионы появились и концентрация их с разбавлением раствора уксусной кислоты сначала все более возрастает.
Разные электролиты имеют разную склонность к расщеплению на ионы. Электролиты, степень диссоциации которых даже в относительно концентрированных растворах велика (близка к 1), называются сильными электролитами, а электролиты, степень диссоциации которых даже в разбавленных растворах мала,- слабыми электролитами. Таким образом, сильные электролиты те, которые легко распадаются на ионы, а слабые те, которые трудно распадаются на ионы. Из кислот к сильным относятся азотная HNO3, серная H2SO4, соляная HCl. Из оснований к сильным относятся гидроокиси щелочных металлов (NaOH, КОН и др.) и гидроокиси бария Ва(ОН)2 и кальция Са(ОН)2. За очень редкими исключениями, к числу которых принадлежит хлорид меди (II), в растворах солей нерасщепленных молекул не обнаружено. Соли относятся к сильным электролитам независимо от того, образованы ли они сильными или слабыми основаниями и кислотами.
При помощи чувствительных приборов установлено, что чистая вода, хотя и чрезвычайно слабо, проводит электрический ток. Значит, она тоже содержит ионы. Вода диссоциирует в незначительной степени на ионы водорода и ионы гидроксила:
Н2O = Н+ + ОН- (или 2Н2O = Н3O+ + ОН-)
Почему от молекул воды не отщепляется второй протон, т. е. не возникают ионы О2-? Первый протон, отщепляясь, преодолевает притяжение однозарядного иона ОН-; второму протону пришлось бы преодолеть гораздо более сильное притяжение двухзарядного иона О2-.
Степень диссоциации воды - около 10-9 (при комнатной температуре), т. е. на каждый миллиард молекул диссоциирована на ионы лишь одна молекула воды. Вода настолько слабый электролит, что диссоциацией ее на ионы мы обычно пренебрегаем, вспоминая о ней лишь в особых случаях.

- Если к раствору медного купороса прилить концентрированный раствор поваренной соли, окраска изменится из голубой в зеленую. Как это объяснить?
- Что значит выражение: степень диссоциации раствора уксусной кислоты равна 0,3?
- Дан раствор слабого электролита. Как увеличить степень диссоциации его? Как уменьшить?
- Какие электролиты называются сильными, а какие слабыми?
- Концентрированные растворы хлорида кобальта (II) СoСl2 фиолетового цвета, а разбавленные - розового. Какова (предположительно) окраска молекул СoСl2? Какова окраска гидратированных ионов кобальта Сo2+?
- В молекулах каких электролитов (сильных или слабых) ионы связаны прочно, а в каких слабо?
- *Почему воду можно считать и кислотой и щелочью?
- *Какие 4 вида ионов содержатся в водном растворе сульфата натрия (например, при концентрации 1 моль/л)? Каких из них меньше всего, каких больше всего?
- Индикаторы - это обычно соли слабых органических кислот, у которых нерасщепленные молекулы имеют одну (например, у метилового оранжевого - красную), а анионы другую (у метилового оранжевого - желтую) окраску. Почему раствор метилового оранжевого при добавке кислоты изменяет окраску из желтой в красную?
- Каким числом, предположительно, измеряется степень диссоциации гидроокиси кальция?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'