
§ 8. Реакции ионного обмена
Реакции обмена между электролитами в водных растворах мы раньше изображали молекулярными уравнениями, не учитывая, что в действительности в этих реакциях участвуют не молекулы электролита, а ионы, на которые он диссоциирован.
Как такие реакции происходят в действительности, рассмотрим сначала на примере реакций, сопровождающихся выпадением осадков.
Сливая растворы хлорида кальция и нитрата серебра, мы наблюдаем образование осадка хлорида серебра AgCl, в растворе же остается нитрат кальция:
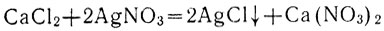
Обе исходные соли - сильные электролиты и в растворе полностью диссоциированы: СаСl2 на ионы Са2+ и ионы Сl-, AgNO3 - на ионы Ag+ и ионы NO3-. Одна из вновь полученных солей Ca(NO3)2 остается в растворе, диссоциированная на ионы Са2+ и NO3-. Поэтому уравнение реакции можно переписать следующим образом:
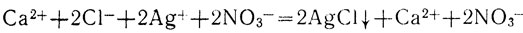
В реакции между растворами СаСl2 и AgNO3 принимают участие лишь ионы серебра и ионы хлора: они соединяются, образуя нерастворимую соль - хлорид серебра. Ионы же Са2+ и NO3- в реакции не участвуют, они остаются свободными, какими были и до сливания растворов.
Удаляя из уравнения общие члены левой и правой частей полного ионного уравнения, получаем уравнение:
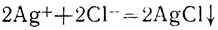
или, сокращая коэффициенты:
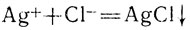
Согласно сокращенному ионному уравнению, такой же осадок должен получаться при сливании любого раствора, содержащего ионы Сl-, с любым раствором, содержащим ионы Ag+. Таким образом, общее свойство соляной кислоты и всех ее растворимых солей образовывать нерастворимый ни в воде, ни в кислотах осадок с солями серебра есть свойство ионов Сl-; это мы выражаем словами: ионы серебра являются реактивом на ионы Сl-. В свою очередь ионы хлора являются реактивом на ионы серебра. Если какой-либо катион может служить для распознавания какого-либо аниона, то этот анион в свою очередь может быть использован для распознавания того же самого катиона.
Сливая растворы хлорида бария и сульфата натрия, мы наблюдаем выпадение осадка сульфата бария:
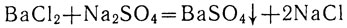
Полное ионное уравнение этой реакции записывают так:
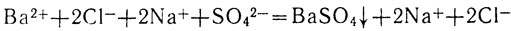
Исключив из уравнения формулы ионов Na+ и Сl-, не участвовавших в реакции, получаем сокращенное ионное уравнение:
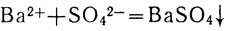
Таким образом, реакция между сульфатом натрия и хлоридом бария заключается в соединении ионов бария с ионами кислотного остатка серной кислоты, в результате чего получается нерастворимый в воде сульфат бария. Сокращенное уравнение указывает, что осадок сульфата бария должен получаться при сливании любого раствора, содержащего ионы Ва2+, с любым раствором, содержащим ионы SO42-, т. е. при сливании растворов серной кислоты или ее солей с растворами солей бария.
Таким образом, общее свойство серной кислоты и всех ее растворимых солей образовывать нерастворимый ни в воде, ни в кислотах осадок при взаимодействии с солями бария есть свойство ионов кислотного остатка SO42-. Это мы выражаем словами: ионы бария являются реактивом на ионы SO42-, и наоборот.
В результате реакции между ионами могут получаться не только осадки но и малодиссоциирующие вещества. Приливая к разбавленному раствору едкого натра разбавленный раствор соляной кислоты до тех пор, пока лакмусовая бумажка при погружении в раствор не примет фиолетовую окраску, мы не наблюдаем видимых признаков реакции: никакого осадка не образуется. Но реакция произошла: кислый вкус раствора кислоты исчез. Опустив в раствор термометр, можно убедиться, что раствор нагрелся, следовательно, выделилась теплота. Произошла реакция нейтрализации, которую раньше мы выражали молекулярным уравнением:
NaOH + HCl = NaCl + H2O
Оба исходных вещества NaOH и НСl и один из продуктов реакции NaCl - сильные электролиты. Они диссоциированы на ионы. Что же касается второго продукта реакции - воды, то она, как нам известно, на ионы почти не распадается. Учитывая это, составляем следующее полное ионное уравнение нейтрализации раствора соляной кислоты раствором едкого натра:
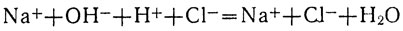
Вычеркивая из уравнения формулы тех ионов, которые в реакции не участвовали, получаем сокращенное ионное уравнение:
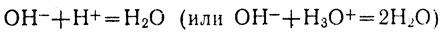
Реакция нейтрализации раствора любой кислоты раствором любой щелочи сводится, таким образом, к соединению ионов Н+ и ОН- в недиссоциированные молекулы воды. Это подтверждается Тем, что при нейтрализации одинаковых количеств раствора какой-либо щелочи растворами разных сильных кислот выделяется одно и то же количество теплоты (как и при нейтрализации одинаковых количеств какой-либо сильной кислоты разными щелочами):
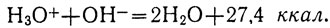
Соль при реакции нейтрализации не выделяется потому, что вода препятствует ионам металла и ионам кислотного остатка соединиться друг с другом. Чтобы выделить соль, необходимо выпарить воду.
Если к раствору карбоната натрия прилить раствор серной кислоты, то происходит образование новой соли и новой кислоты - угольной, распадающейся на воду и углекислый газ.
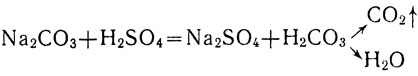
Карбонат натрия, серная кислота и сульфат натрия, как сильные электролиты, в растворе диссоциируют на ионы. Учитывая это, можно составить следующее полное уравнение взаимодействия растворов карбоната натрия и серной кислоты:
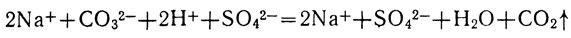
Исключив из уравнения обозначения тех ионов, которые не участвовали в реакции, получим сокращенное ионное уравнение:
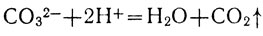
Обобщая сказанное выше, можно сделать вывод, что реакции между растворами электролитов происходят в тех случаях, когда в результате их образуются малодиссоциирующие вещества или вещества, уходящие из раствора в виде осадка или в виде газа. Таким образом, все реакции обмена в растворах электролитов протекают в направлении связывания ионов. Так как в растворах слабых электролитов преобладают их молекулы, а не ионы, мы и впредь в ионных уравнениях будем представлять расщепленными на ионы только сильные электролиты.
Если слить разбавленные растворы хлорида натрия и нитрата кальция, то никакой реакции не происходит, так как не образуется ни осадка, ни газа, ни малодиссоциирующего вещества. В самом деле, если молекулярное уравнение возможной в данном случае реакции
2NaCl + Ca(NO3)2 = 2NaNO3 + CaCl2
выразим в ионной форме, то получим:
2Na+ + 2Cl- + Ca2+ + 2NO3- = 2Na+ + 2NO3- + Ca2+ + 2Cl-
Никаких изменений в химическом составе раствора не произошло.

- Напишите полные и сокращенные ионные уравнения реакций между ? А растворами: а) хлорида калия и нитрата серебра, б) едкого кали и нитрата меди (II), в) сульфата натрия и нитрата бария, г) сульфата алюминия и хлорида бария. Как объяснить, что в двух последних случаях получается одно и то же сокращенное ионное уравнение?
- Напишите полные и сокращенные ионные уравнения реакций между растворами: а) азотной кислоты и гидроокиси кальция, б) гидроокиси бария и серной кислоты. Как будет изменяться свечение лампочки, если последнюю реакцию проводить, прибавляя порция за порцией один раствор к другому в приборе для обнаружения электропроводности растворов (рис. 1)?
- Объясните, почему идут до конца реакции: а) между кристаллической поваренной солью и концентрированным раствором серной кислоты, б) между растворами едкого кали и азотной кислоты, в) между растворами хлорида бария и сульфата натрия.
- *В 1 л воды растворили 2 моля нитрата натрия и 1 моль сульфата калия. Из каких других двух веществ и как можно приготовить раствор в точности такого же состава?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'