
§ 10. Гидролиз солей
При диссоциации воды образуется ничтожно малое и при этом одинаковое количество ионов Н+ и ионов ОН-. Растворы, в которых концентрация ионов Н+ и ОН- одинакова, как в чистой воде, мы называем нейтральными, растворы, в которых преобладают ионы ОН-, щелочными, а растворы, в которых преобладают ионы Н+, кислыми: Нейтральны растворы солей, образованных сильной кислотой и сильным основанием, например NaCl, KNO3. Фиолетовый лакмус окраски в них не меняет.
Возьмем теперь раствор соли, образованный слабой кислотой и сильным основанием, например раствор соды Na2CO3 (соль образована слабой кислотой Н2СО3 и сильным основанием NaOH). Лакмус в нем окрашивается в синий, а фенолфталеин - в малиновый цвет: раствор оказывается щелочным, в нем присутствуют в избытке ионы гидроксила. Откуда взялись они? Сода - сильный электролит, она диссоциирует на ионы натрия Na+ и ионы кислотного остатка угольной кислоты СО32-:
Na2CO3 = 2Na+ + CO32-
!Угольная кислота Н2СO3 относится к слабым кислотам. Это значит, что ионы водорода в ее молекулах прочно связаны с кислотным остатком и с трудом от него отщепляются. В таком случае ионам СО32- должно быть свойственно связывать ионы водорода. Они могут даже отнимать их от молекул воды:
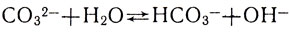
При этом ион водорода нейтрализует одну единицу отрицательного заряда иона кислотного остатка СO32- и превращает его в отрицательно однозарядный ион НСO3-, а из молекулы воды освобождается ион гидроксила. Эти ионы гидроксила и придают раствору соды щелочную реакцию.
Такие реакции между солями и водой относятся к реакциям гидролиза (от греческих слов: гидро - вода, лизис - разложение).
Гидролиз солей, образованных слабой кислотой и сильным основанием, заключается в присоединении ионами кислотного остатка ионов водорода от молекул воды с освобождением из них ионов гидроксила:
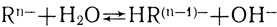
(Rn- - ион кислотного остатка любой слабой кислоты). Возьмем теперь раствор соли, образованной сильной кислотой и слабым основанием, например хлорид алюминия АlСl3 (соль образована сильной кислотой НСl и слабым основанием Аl(ОН)3).
Лакмус в растворе хлорида алюминия окрашивается в красный цвет, метиловый оранжевый - в розовый цвет; раствор оказывается кислым, в нем содержатся в избытке ионы водорода. Откуда взялись они? Соль диссоциирует на ионы алюминия Аl3+ и хлора Сl-. Гидроокись алюминия относится к слабым основаниям: она практически нерастворима в воде. Это значит, что ионы гидроксила прочно удерживаются ионами алюминия и с трудом от них отщепляются. Но в таком случае свободным ионам алюминия должно быть свойственно присоединять ионы гидроксила:
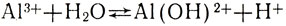
При этом ион гидроксила, присоединившись к иону алюминия, нейтрализует одну единицу его положительного заряда, и получается положительно двухзарядный ион Аl(ОН)2+, а из молекулы воды освобождается ион водорода. Эти ионы водорода и придают раствору кислую реакцию.
Гидролиз солей, образованных слабым основанием и сильной кислотой, заключается в присоединении ионами металла ионов гидроксила от молекул воды с освобождением из них ионов водорода:
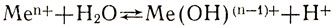
Как правило, реакции гидролиза обратимы, и с ионом металла (в случае солей слабых оснований) или ионом кислотного остатка (в случае солей слабых кислот) реагирует одна молекула воды.
- Составьте в ионной форме уравнения гидролиза: а) сульфата меди (II), б) сульфида калия, в) фосфата лития Li3PO4, r) хлорида железа (II), д) сульфата алюминия, е) сульфида кальция.
- Составьте в ионной форме уравнения: а) электролитической диссоциации и б) следующего за ней гидролиза сульфида калия.
- Выразите ионными уравнениями электролитическую диссоциацию: а) азотной кислоты, б) воды, учитывая, что при этом в растворах появляются не свободные ионы водорода Н+, а ионы гидроксония.
- *Образование щелочей при растворении в воде окислов щелочных металлов и кальция можно представить как две последовательные реакции: а) электролитическую диссоциацию окисла, как ионного соединения, б) следующий за ней гидролиз (см. упражнение 2). Выразите эти реакции ионными уравнениями для окиси натрия.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'