
§ 11. Кислоты и основания в свете теории электролитической диссоциации
При изучении теории электролитической диссоциации нам встретились химические реакции, ионный механизм которых оказался одним и тем же: он заключается в перемещении ионов водорода Н+, или протонов, из одних частиц (молекул или ионов) в другие (молекулы или ионы). К таким реакциям относятся диссоциация кислот, например:
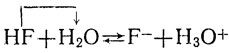
(1)
гидролиз, например:
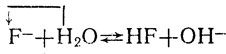
(2)
диссоциация воды:

(3)
реакция нейтрализации:
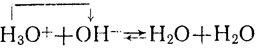
(4)
растворение гидроокисей в кислотах, например:
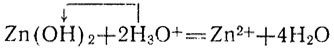
(5)
В каждом случае перемещение протонов указано стрелкой.

Частицы - молекулы или ионы, отщепляющие или присоединяющие протоны, называют протолитами, а реакции, заключающиеся в перемещении протонов,- протолитическими реакциями.
Протолит, отщепляющий в рассматриваемой реакции протоны, называют кислотой, а протолит, присоединяющий протоны,- основанием. Тем самым понятия "кислота" и "основание", которые ранее мы относили только к молекулам, распространяются и на участвующие в таких реакциях ионы. При этом одни и те же частицы (молекулы или ионы) в одной реакции могут выступать как кислота, а в другой - как основание. Так, в реакции 1 (диссоциация плавиковой кислоты) вода выступает в качестве основания (ее молекулы присоединяют протоны), а в реакции 2 (гидролиз солей той же кислоты) - в качестве кислоты (ее молекулы отщепляют протоны), а в качестве основания в этой реакции выступают ионы кислотного остатка F-. При электролитической диссоциации воды (реакция 3) одни ее молекулы, отщепляя протон, выступают в качестве кислоты, а другие, присоединяя протон, в качестве основания. При реакциях нейтрализации (4 и 5) в качестве кислоты выступают ионы гидроксония, а в качестве основания в одном случае ионы гидроксила, в другом - нерастворимая гидроокись.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'