
§ 12. Окислительно-восстановительные реакции
Вы познакомились с ионным механизмом реакции обмена в растворах электролитов. Общая особенность этих реакций заключается в том, что валентность участвующих в них атомов не изменяется. Но вам известны другие виды химических реакций, к числу которых относятся реакции окислительно-восстановительные.
Вспомним, что валентность каждого атома выражает число электронов, затраченных им на спаривание с электронами присоединенных к нему атомов. В зависимости от того, оттянуты ли при этом электроны от данного атома к атомам, связанным с ним, или наоборот, к численному значению валентности приписывается соответственно знак + или -. Так обозначаемая валентность называется окислительным числом. Во всех рассматриваемых нами соединениях валентность каждого атома по величине и по знаку совпадает с его окислительным числом. Но в простых веществах (за исключением инертных газов) валентность выражается числами, отличными от нуля, а окислительное число принимается равным 0, так как связи атомов "в них неполярные и смещение электронов отсутствует.
Вспомним реакцию восстановления меди из ее окиси водородом. Проставим над знаком каждого элемента в уравнении реакции окислительное число, в виде соответствующего числа знаков "+", или "-", или же "0", если вещество простое и состоит поэтому из электронейтральных атомов:
Cu2+O2- + H2 = Cu0 + H2+O2-
Подчеркнем знаки элементов, у которых изменилось окислительное число. Это медь и водород.
Ионы меди Сu2+ превратились в электронейтральные атомы. Ионам меди недоставало (до атома) двух электронов. Превратившись в атомы, они эту недостачу восполнили, т. е. получили 2 электрона.
Электронейтральные атомы водорода Н0 превратились в ионы Н+, т. е. потеряли по одному электрону. Произошло перемещение электронов от атомов водорода к ионам меди. Это - главное и существенное в данной реакции. Все остальное - следствия. Утратив заряд, атомы меди перестали притягиваться ионами кислорода, и медь выделилась в свободном виде. Получив положительный заряд, ионы водорода притянулись к отрицательно заряженным ионам кислорода, и образовались молекулы воды. Так как решающее значение в реакциях окисления-восстановления имеет перемещение электронов, окислительно-восстановительными мы назвали все реакции, обусловленные перемещением электронов от какого-либо одного элемента к другому; об элементе, отдающем электроны, условились говорить, что он окисляется, а об элементе, получающем электроны, что он восстанавливается.
В рассматриваемой нами реакции атомы водорода отдают электроны, значит, водород окисляется (так мы говорили о нем и при первом знакомстве с этой реакцией, только мотивировали иначе: окисляется потому, что присоединяет кислород). Ионы меди присоединяют электроны, значит, медь восстанавливается (так мы говорили о ней и раньше, но мотивировали тоже иначе: восстанавливается, потому что освобождается от связи с кислородом).
При составлении уравнений окислительно-восстановительных реакций коэффициенты в них подбираются из расчета: сколько электронов приобретают атомы (или ионы) элемента-окислителя, столько электронов теряют атомы (или ионы) элемента-восстановителя. Например, задана схема реакции:
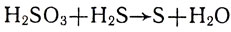
Найдем по формулам и проставим над химическим знаком каждого элемента его окислительное число:
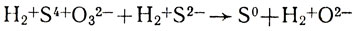
Окислительное число изменилось у атомов серы: в сернистой кислоте с 4+ до 0, в сероводороде с 2- тоже до 0. Запишем происходящее при реакции перемещение электронов в виде электронных уравнений:
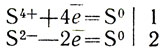
Число электронов, отдаваемых атомами S2-, должно равняться числу электронов, присоединяемых атомами S4+. Значит, на каждый атом S4+, иначе говоря на каждую молекулу сернистой кислоты, в реакции должны участвовать два атома S2-, иначе говоря, две молекулы сероводорода H2S. Отмечаем это числами 1 и 2, проставленными за чертой справа от электронных уравнений. Коэффициенты при формулах, участвующих в реакции веществ, найдены. Введя их в заданную схему реакции, получаем уравнение:
H2SO3 + 2H2S = 3S + 3H2O

- В чем заключается отличие окислительно-восстановительных реакций от реакций обмена с точки зрения электронной теории?
- Разберите с точки зрения электронной теории реакции: а) разложение окиси ртути нагреванием, б) синтеза сульфида железа, в) действие цинка на соляную кислоту. Почему эти реакции относятся к окислительно-восстановительным? Какой элемент в каждом случае окисляется, какой восстанавливается?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'