
§ 13. Электролиз
Восстановить химический элемент - это значит доставить его атомам или ионам электроны. Окислить элемент - это значит отщепить от его атомов или ионов электроны. То и другое можно осуществить не только при помощи обычных химических реакций, но и действием электрического тока. Нальем в U-образную трубку (рис. 5) раствор хлорида меди (II), погрузим в каждое колено угольный электрод и присоединим оба электрода проводами к аккумулятору. Электрод, служивший катодом, будет покрываться слой за слоем красной металлической медью, а на аноде будет выделяться свободный хлор, обнаруживаемый по запаху. При действии электрического тока происходит химическая реакция - хлорид меди (II) разлагается на медь и хлор:
CuCl2 = Cu + Cl2 ↑ (1)
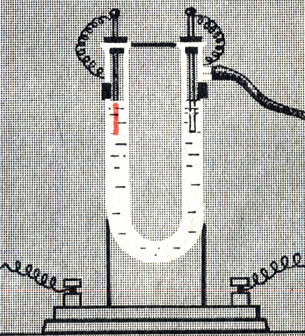
Рис. 5. Прибор для электролиза
Рассмотрим, что при этом происходит с точки зрения электронной теории. Аккумулятор, действуя наподобие "электронного насоса", как бы перекачивает электроны из одного электрода в другой. Электрод, из которого электроны "выкачиваются", заряжается положительно и становится анодом; электрод, в который электроны "накачиваются", заряжается отрицательно и становится катодом.
Хлорид меди (II) в растворе диссоциирован на ионы меди и ионы хлора:
CuCl2 = Cu2+ + 2Cl- (2)
Беспорядочное движение ионов при включении тока становится направленным. Положительно заряженные ионы меди направляются к отрицательно заряженному электроду - катоду, а отрицательно заряженные ионы хлора - к положительно заряженному - аноду. Достигнув катода, ионы меди захватывают от него электроны, т. е. восстанавливаются, превращаясь в электронейтральные атомы меди:
Cu2++2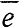 = Cu0 (3)
= Cu0 (3)
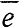 = Cu0 (3)
= Cu0 (3)На поверхности катода отлагается металлическая медь. (То же самое, очевидно, будет происходить на катоде при замене в растворе хлорида меди (II) любой другой растворимой солью меди.) Анионы хлора, достигнув анода, наоборот, отдают по одному электрону, т. е. окисляются и тоже превращаются из ионов в электронейтральные атомы, которые, соединяясь попарно, образуют молекулы свободного хлора:
Сl- - 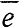 = Сl0, Сl + Сl = Сl2 (4)
= Сl0, Сl + Сl = Сl2 (4)
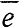 = Сl0, Сl + Сl = Сl2 (4)
= Сl0, Сl + Сl = Сl2 (4)(Очевидно, что то же самое будет происходить на аноде, если в растворе хлорид меди (II) заменить любым другим растворимым хлоридом.)
Если теперь просуммировать левые и правые части уравнений 2, 3, и 4, то получим приведенное выше итоговое уравнение 1 (проверьте!).
Окислительно-восстановительные реакции под действием электрического тока называются электролизом. Прохождение электрического тока через растворы или расплавы электролитов всегда сопровождается электролизом: на катоде происходит восстановление, на аноде - окисление.
Подвергнем теперь электролизу в той же U-образной трубке вместо раствора хлорида меди (II) раствор иодида калия, добавив в одно колено трубки, куда будет погружен катод, раствор фенолфталеина, а в другое, куда будет погружен анод, раствор крахмала. По включении тока отрицательный электрод - катод - покроется пузырьками газа - это водород. Раствор вблизи катода окрасится в малиновый цвет: в нем появилась щелочь, очевидно, едкое кали КОН. А около анода раствор окрасится в синий цвет, значит, здесь выделился свободный иод. Таким образом, при электролизе водного раствора иодида калия мы получаем три продукта: на катоде водород и едкое кали, на аноде - свободный иод.
Почему же в этом случае, в отличие от электролиза раствора хлорида меди (II), на катоде выделяется не металл (калий), а водород?
Иодид калия диссоциирует на ионы калия К+ и ионы иода I-:
KI K+ + I-
K+ + I-
 K+ + I-
K+ + I-Диссоциирует на ионы, хотя и в ничтожной степени и вода:
H2O  H+ + OH-
H+ + OH-
 H+ + OH-
H+ + OH-Поэтому в растворе присутствуют четыре вида ионов: катионы калия К+ и водорода Н+ и анионы иода I- и гидроксила ОН-. В проведении тока раствором участвуют все содержащиеся в нем ионы, но главным образом, те, концентрация которых велика: в нашем случае ионы калия и иода. Разряжаются же на электродах те ионы, разрядка которых требует меньшей затраты энергии, хотя бы концентрация их в растворе была мала. Ионы иода легче отдают электроны, чем ионы гидроксила. Поэтому на аноде отдают электроны, т. е. окисляются, ионы иода:
2I- - 2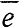 = 2I0; 2I0 = I2
= 2I0; 2I0 = I2
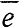 = 2I0; 2I0 = I2
= 2I0; 2I0 = I2Принимают же электроны легче ионы водорода, чем ионы калия. Поэтому ионы калия, направляющиеся при электролизе к катоду, будут скапливаться у катода, но разряжаться на нем не будут. Захватывать электроны, т. е. восстанавливаться, будут ионы водорода:
2Н+ + 2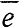 = 2Н0; 2Н0 = Н2
= 2Н0; 2Н0 = Н2
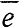 = 2Н0; 2Н0 = Н2
= 2Н0; 2Н0 = Н2Соединяясь попарно, атомы водорода образуют молекулы Н2.
Концентрация ионов водорода в нашем растворе очень мала. Но их убыль у катода в результате разрядки тотчас восполняется расщеплением новых и новых молекул воды на ионы Н+ и ОН-, вследствие чего разрядка ионов Н+ на катоде идет безостановочно. Одновременно вблизи катода происходит накопление ионов гидроксила.
Суммарно электролиз водного раствора иодида калия можно выразить уравнением:
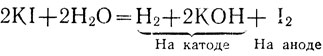
При электролизе водных растворов бескислородных кислот и их солей (кроме НF) на аноде окисляются ионы кислотного остатка, а при электролизе водных растворов высших кислородных кислот и их солей ионы гидроксида.
Из изложенного можно сделать следующие выводы. Электролизу подвергаются только электролиты. Образующим их ионам предварительно должна быть обеспечена свободная подвижность. Это достигается двумя способами: электролит должен быть либо растворен в воде, либо расплавлен.
Электролиз растворов электролитов проводить легче, чем электролиз их расплавов, так как электролиты - соли и щелочи - плавятся при очень высоких температурах. Но не всякий элемент может быть получен в свободном состоянии электролизом водных растворов его соединений. Очевидно, что таким путем нельзя получить, например, щелочные металлы. В таких случаях прибегают к электролизу расплавов.

- Разберите, из каких процессов слагается электролиз водных растворов: а) иодистоводородной кислоты, б) хлорида калия.
- В раствор хлорида никеля (II) NiCl2 погрузили стальное изделие и угольный стержень. Изделие присоединили проводником к отрицательному полюсу аккумулятора, а стержень - к положительному. Изделие покрылось слоем никеля. Разберите, из каких процессов слагается электролиз. Каков его практический результат?
- Посредством электролиза водного раствора хлорида натрия в промышленности получаются три ценных продукта. Какие именно? (Составьте схему электролиза по примеру схемы для иодида калия.)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'