
§ 15. Окислы и гидраты окислов
Во всеоружии электронно-ионных представлений мы возвращаемся к классификации сложных веществ. Как вам известно, особое значение в этой классификации уделяется соединениям элементов с кислородом - окислам элементов - и продуктам соединения окислов с водой - гидратам окислов, потому что кислород является преобладающим элементом в окружающей нас природе, а вода - преобладающим в ней растворителем.
Кислород - самый электроотрицательный из химических элементов, за исключением фтора. Поэтому при соединении с кислородом всех остальных элементов электроны от их атомов смещаются к атомам кислорода, дополняя шестиэлектронный внешний слой атомов кислорода до 8: кислород в окислах отрицательно двухвалентен.
В окислах типичных металлов химическая связь ионная, при переходе же от металлов к неметаллам связь в окислах становится полярной ковалентной.
Большинство окислов не растворяется в воде и не соединяется с нею. Соединяются с водой, превращаясь в гидраты окислов, окислы наиболее ярко выраженных металлов и наиболее ярко выраженных неметаллов. Гидраты окислов первых, являются основаниями, например NaOH, а вторых - кислотами, например H2SO4. В гидратах окислов валентность элементов остается той же, какова она в отвечающих им окислах.
Молекулы высших окислов неметаллов, даже принадлежащих к одной и той же группе, обращаясь в кислоты, могут присоединять разное число молекул воды: например, молекула серного ангидрида - одну, а молекула теллурового ангидрида - три молекулы воды. Поэтому высшие кислородные кислоты таких неметаллов имеют неодинаковую форму:

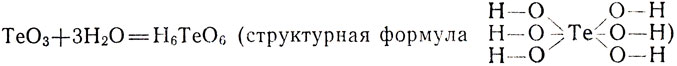
Изменение формы высших кислородных кислот неметаллов одной и той же группы объясняется тем, что с возрастанием порядкового номера неметалла увеличивается радиус его атома, а с увеличением радиуса атом может разместить вокруг себя большее число атомов кислорода. Формулы высших кислородных кислот неметаллов приведены в таблице 1. Они размещены в ней так же, как соответствующие элементы в периодической таблице. В кислотах неметаллов II периода, как видно из таблицы 1, к атому неметалла присоединено 3, у неметаллов III и IV периода - 4, а у неметаллов V периода - 6 атомов кислорода.
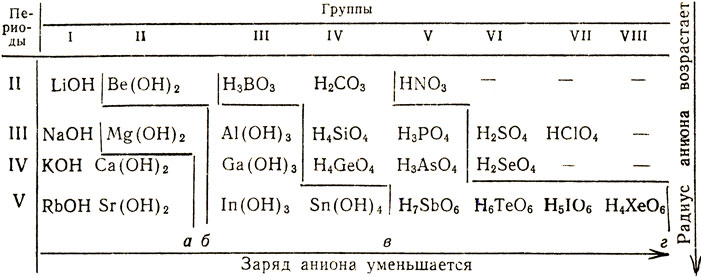
Таблица 1
- Приведите по одному примеру реакций соединения и разложения, которые: а) относятся к окислительно-восстановительным реакциям, б) не относятся к окислительно-восстановительным реакциям.
- Составьте структурные формулы: а) йодной кислоты, б) ксеноновой кислоты.
- * Кроме фосфорной кислоты Н3РО4, существуют метафосфорные кислоты с общей формулой (НРО3)n, где n>2, в которых как и в Н3РO4, каждый атом фосфора связан с 4 атомами кислорода. Напишите структурные формулы кислот: Н3Р3O9 и H4P4O12. (Указание: атомы фосфора связаны в кольцо через атомы кислорода.)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'