
§ 16. Зависимость свойств гидратов окислов от зарядов и радиусов ионов
Поставим вопрос: почему, например, едкий натрий - основание, а не кислота, серная кислота - кислота, а не основание? Зависит ли это от строения молекул? Выпишем структурные формулы гидратов окислов элементов II периода;
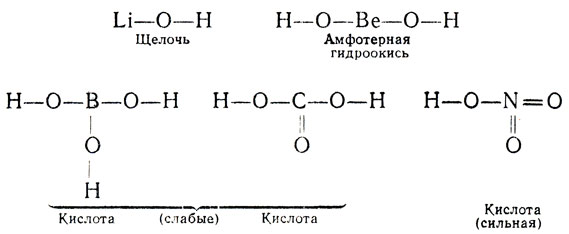
Никакой существенной разницы в строении молекулы между кислотами и основаниями нет. В самом деле, по приведенной структурной формуле гидрата окиси бора мы не догадались бы, что это кислота, Только зная из опыта, что гидрат окиси бора ведет себя, как кислота, мы пишем его формулу в виде Н3ВО3, а не В(ОН)3. Ответ на вопрос, почему кислоты являются кислотами, а основания - основаниями, следует искать в неодинаковой прочности взаимных связей частиц, образующих молекулу.
Представим себе упрощенно молекулу гидроокиси лития как сцепление ионов O2-, Li+ и протона Н+, радиус которого (ведь это ядро водородного атома!) практически равен нулю (рис. 6). Молекула может расщепиться по грани а - на ионы Li+ и OH- и по грани б: в этом случае она распалась бы на ион Н+ и остаток (LiO)-. Так диссоциируют кислоты. Почему же расщепление происходит по грани а, а не по грани б?
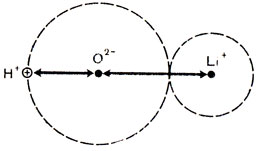
Рис. 6. Схема молекулы гидрокиси лития
Вспомним из курса физики: одноименно заряженные тела отталкиваются, а разноименно заряженные притягиваются с тем большей силой, чем больше их заряды и чем меньше расстояние между ними. При этом в случае шарообразных тел за расстояние между ними принимается расстояние между их центрами.
Ион Li+ и протон Н+ имеют заряды, одинаковые и по величине (1) и по знаку (+), они взаимно отталкиваются. Но их удерживает в молекуле притяжение к отрицательно заряженному иону кислорода. Расстояния между ними и ионом кислорода неодинаковы. По рисунку видно, что протон ближе к иону кислорода, чем ион лития. Значит, ион Li+ должен удерживаться в молекуле слабее, чем протон: этим и объясняется, что гидроокись лития диссоциирует как основание.
При переходе от гидроокиси лития к гидроокиси бериллия, далее - к гидрату окиси бора и т. д. заряд центрального иона возрастает, связь его с кислородными ионами усиливается, переходя из ионной в полярноковалентную. Отщепление ионов гидроксила все более затрудняется, т. е. основные свойства утрачиваются.
Примем теперь во внимание отталкивание ядром центрального иона (лития, затем бериллия, бора и т. д.) протонов, содержащихся в гидроксильных группах, при переходе от гидроокиси лития к гидроокиси бериллия, к гидрату окиси бора и т. д. заряд ядра центрального иона возрастает, возрастает и отталкивание им протонов. Связь протонов с молекулой все более ослабляется, они получают возможность отщепляться от молекулы, т. е. появляются кислотные свойства. Основания сменяются кислотами, сила которых возрастает от борной кислоты к азотной.
Пограничное положение между основаниями и кислотами в нашем ряду занимает гидрат окиси бериллия Be(ОН)2. Его молекулы могут расщепляться как на ионы Be2+ и ОН-, так и на ионы Н+ и ВеО22-, поэтому он проявляет свойства и основания и кислоты, т. е. амфотерен. Теперь мы можем понять зависимость характера гидрата окисла элемента от положения элемента в периодической системе.
Электролитическая диссоциация оснований заключается в отрыве от ионов металла ионов гидроксила. Связь их с ионами металла тем прочнее, чем больше заряд иона металла и чем меньше его радиус.
В каждом периоде с возрастанием порядкового номера элемента возрастает заряд его иона и несколько уменьшается его радиус (из-за стяжения электронной оболочки к ядру). Поэтому сила оснований, образуемых элементами одного и того же периода, уменьшается с возрастанием порядкового номера элемента.
В каждой из главных подгрупп с возрастанием порядкового номера элемента заряд его иона остается одним и тем же но радиус иона возрастает (из-за увеличения числа электронных слоев). Поэтому сила оснований, образуемых элементами одной и той же главной подгруппы, возрастает с возрастанием порядкового номера элемента. У щелочных металлов, например, это проявляется в возрастании растворимости их гидроокисей.
Электролитическая диссоциация кислот заключается в отщеплении от ионов кислотного остатка ионов водорода. Связь их с ионом кислотного остатка тоже тем прочнее, чем больше заряд иона кислотного остатка и чем меньше его радиус. Приведем в качестве примера (табл. 2) степени диссоциации в растворах двухосновных кислот при одной и той же концентрации (0,1 моль/л).

Таблица 2
1 (Так как вода диссоциирует, отщепляя ионы водорода, ее можно считать кислотой.)
В этом ряду возрастание силы кислот обусловлено возрастанием радиуса аниона при неизменном его заряде. В ряду же высших кислородных кислот элементов одного и того же, например V периода, наоборот, возрастание силы кислот обусловлено уменьшением заряда анионов при почти одинаковых радиусах их (табл. 3).
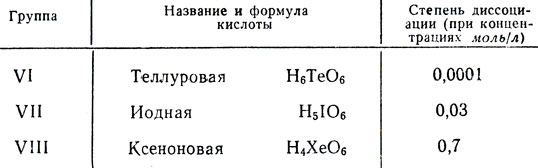
Таблица 3
Рассмотрим, как разместились основания и кислоты в таблице высших гидратов окислов элементов главных подгрупп периодической системы (табл. 1). Рассекающие чертеж линии обозначают границы: а) между сильными основаниями (щелочами) и слабыми основаниями; б) между основаниями и амфотерными гидроокисями; в) между амфотерными гидроокисями и кислотами; г) между слабыми и сильными кислотами. Так, ряд гидроокисей элементов III периода начинается щелочью NaOH, за ней следует слабое, почти нерастворимое в воде основание Mg(OH)2, затем амфотерная гидроокись Аl(ОН)3, а далее - кислоты: очень слабая H4SiO4, затем кислота средней силы Н3РO4 и сильные кислоты H2SO4 и НСlO4. Последняя является самой сильной из всех кислородных кислот: она одна остается сильной при растворении в таких растворителях, в которых другие сильные кислоты обнаруживают лишь незначительную электропроводность (например, в безводной уксусной кислоте).

- Как объясняется изменение с возрастанием порядкового номера элемента: а) основных свойств, б) кислотных свойств гидратов окислов элементов одного и того же периода?
- Как изменяется положение амфотерных гидроокисей в периодах при переходе от каждого периода к следующему за ним? Почему?
- Почему в IV и V периодах, в отличие от III периода, между сильным основанием (щелочью) и амфотерной гидроокисью в таблице отсутствует слабое основание? (Указание: сравните таблицу 1 с периодической таблицей.)
- Соли мышьяковой кислоты подвергаются гидролизу в меньшей степени, чем соли фосфорной кислоты в растворах одинаковой концентрации. Как вы это объясните? (Указание: составьте в ионной форме уравнения гидролиза, например фосфата натрия и арсената натрия; учтите небольшую разницу в размерах ионов кислотных остатков РO43- и AsO43-.)
- Селен по порядковому номеру занимает промежуточное положение между серой и теллуром. Между тем селеновая кислота по силе не занимает промежуточного положения между серной и теллуровой: она гораздо сильнее теллуровой кислоты и немного сильнее серной кислоты. Как вы это объясните?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'