
§ 17. Химические свойства гидратов окислов и солей
Основания. 1) Наиболее общее химическое свойство оснований: все они реагируют с сильными кислотами с образованием соли и воды. Реакции между растворами щелочей и сильных кислот сводятся к соединению уже отщепленных от щелочи ионов гидроксила с отщепленными от кислоты ионами водорода в молекулы воды:
ОН- + Н+ = Н2О
При взаимодействии с растворами кислот нерастворимых оснований отщепление от оснований ионов гидроксила происходит в процессе самой реакции, например:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
или в ионной форме:
Сu(ОН)2 + 2Н+ = Сu2+ + 2Н2O
2) Щелочи реагируют с растворами солей с образованием новой соли и нового основания. Примером может служить реакция между растворами едкого натра и сульфата меди (II). При сливании растворов получается голубой осадок нерастворимой в воде гидроокиси меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
или в ионной форме ...?
Такие реакции происходят, если ожидаемое новое основание или соль относится к нерастворимым веществам (см. таблицу растворимости на стр. 204).
Кислоты. 1) Наиболее общее химическое свойство кислот: все они реагируют со щелочами с образованием соли и воды. Реакция заключается в соединении отщепленных от кислоты при ее растворении или в процессе реакции (если кислота нерастворима) ионов водорода с ионами гидроксила от щелочи в молекулы воды, например:
H2SiO3 + 2NaOH = Na2SiO3 + 2H2O
или в ионной форме ...?
2) Кислоты (кроме HNO3) и их растворы реагируют с металлами, расположенными до водорода в электрохимическому ряду напряжений (см. стр. 126), с образованием соли и выделением водорода. Так, цинк в растворе серной кислоты "растворяется", превращаясь в сульфат цинка и вытесняя из кислоты водород:
Zn + H2SO4 = ZnSO4 + H2↑
или в ионной форме:
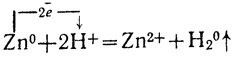
Такие реакции сводятся к восстановлению атомами металла ионов водорода.
Амфотерные гидроокиси. Все амфотерные гидроокиси практически нерастворимы в воде, но растворяются и в растворах сильных кислот и в растворах щелочей, реагируя с теми и другими с образованием соли и воды, например:
а) Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
или в ионной форме:
Zn(OH)2 + 2H+ = Zn2+ + 2H2O
б) H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O
или в ионной форме:
Zn(OH)2 + 2OH- = ZnO22- + 2H2O
- Перечислите химические свойства оснований. Приведите примеры, напишите уравнения реакций в ионной форме.
- Напишите уравнения реакций между: а) гидроокисью алюминия и раствором серной кислоты, б) раствором едкого кали и хлорида железа (III), в) гидроокисью железа (III) и раствором азотной кислоты, г) двуокисью кремния SiO2 (белый песок) и раствором едкого кали, д) растворами гидроокиси кальция и сульфата меди (II) - в молекулярной и ионной форме, справляясь в таблице растворимости.
- Перечислите химические свойства кислот. Приведите примеры реакций, подтверждающих каждое свойство, напишите уравнения этих реакций в молекулярной и ионной форме.
- Напишите уравнения реакций раствора серной кислоты: а) с алюминием, б) с окисью цинка (она в воде нерастворима), в) с раствором гидроокиси кальция, г) с раствором хлорида бария (справляясь в таблице растворимости) - в молекулярной и ионной форме.
Соли. 1) В водных растворах соли могут реагировать со щелочами с образованием новой соли и нового основания, например:
CuSO4 + 2NaOH = Си(ОН)2 + Na2SO4
или в ионной форме ...?
Необходимым условием таких реакций является нерастворимость в воде хотя бы одного из двух продуктов реакции.
2) В водных растворах соли могут реагировать с кислотами с образованием новой соли и новой кислоты, если хотя бы один из двух продуктов реакции в воде и во вновь получающейся кислоте нерастворим, например:
BaCl2 + H2SO4 = BaSO4 + 2HCl
или в ионной форме ...?
3) В водных растворах соли могут реагировать между собой с образованием двух новых солей, если хотя бы одна из них в воде нерастворима, например:
CuSO4 + BaCl2 = BaSO4 + CuCl2
или в ионной форме ...?
4) В водных растворах солей металл, входящий в их состав, может замещаться другими, более активными металлами, например:
Fe + CuSO4 = Cu + FeSO4
или в ионной форме ...?
Такие реакции сводятся к восстановлению атомами замещающего металла ионов замещаемого металла.

- Перечислите химические свойства солей. Приведите подтверждающие каждое свойство примеры с уравнениями реакций в молекулярной и ионной форме.
- Напишите в молекулярной и ионной форме уравнения реакций между растворами: а) сульфата магния и хлорида бария, б) хлорида меди (II) и гидроокиси калия, в) фосфата натрия и нитрата алюминия, г) карбоната калия и хлорида кальция, д) нитрата цинка и карбоната натрия, справляясь в таблице растворимости.
- Как из окиси меди получить: а) нитрат меди (II), б) гидроокись меди (II)? Напишите уравнения реакций в молекулярной и ионной форме.
- Напишите уравнения реакций получения всеми возможными способами: а) хлорида цинка, б) сульфата цинка.
- Заполните таблицу 4, вписав в соответствующие клетки названия продуктов реакции (если реакция возможна) между веществами, перечисленными в верхней и боковой графах.

Таблица 4 - Приведите примеры окислительно-восстановительных реакций, которые по другой классификации относятся: а) к реакциям соединения, б) к реакциям разложения, в) к реакциям замещения.
- Приведите примеры: а) реакции соединения, б) реакции разложения, которые не относятся к окислительно-восстановительным реакциям.
- * Как экспериментальным путем убедиться, что данная вам гидроокись металла амфотерна?

- Повторите из курса химии VIII класса параграфы 72 ("Движение электронов в атомах") и 80 ("Электроотрицательность").
- Перенесите на отдельный лист бумаги форму таблицы 5.
Заполните последовательно все столбцы. Вертикальными стрелками укажите направления, в которых изменяются неметаллические и металлические свойства элементов. Объясните записи, сделанные вами, на основе данных об электронных структурах атомов.

Таблица 5. Характеристика элементов главной подгруппы V группы периодической системы элементов
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'