
2. Пятая группа периодической системы элементов
§ 18. Общая характеристика элементов подгруппы азота
В VIII классе вы изучили типичные неметаллы - элементы главных подгрупп VI и VII групп периодической системы. Продолжая далее изучение химических элементов, рассмотрим теперь неметаллы V группы. Они образуют главную подгруппу ее. Внешний слой их атомов состоит из 5 электронов, а именно из двух спаренных s-электронов и 3 неспаренных р-электронов.
До завершения слоя недостает 3 электронов. Поэтому наибольшее число электронов, которое может отделиться от атома, равно 5, а число электронов, которое может к нему присоединиться, равно 3. В первом случае элемент проявит положительную, во втором - отрицательную валентность. Эти свойства атомов данных неметаллов определяют состав их высших окислов и водородных соединений: первые отвечают общей формуле R25+ O52- (например, N2O5 - азотный ангидрид, P2O5 - фосфорный ангидрид, а вторые - общей формуле R3-H3+ (например, NH3 - аммиак, РН3 - фосфористый водород).
Молекулы водородных соединений образуются за счет спаривания 3 неспаренных р-электронов атома неметалла с неспаренными электронами 3 атомов водорода. Электронные облака р-электронов имеют, как вам известно, вытянутую, гантелеобразную форму, и их оси взаимно перпендикулярны. Поэтому три атома водорода присоединяются к атому неметалла так, что их связи образуют одна с другой углы около 100°, т. е. молекулы RH3 имеют пирамидальную форму (рис. 7). Водородные соединения неметаллов V группы, как и всех неметаллов, летучи.
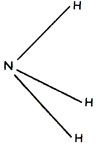
Рис. 7. Форма молекулы аммиака
При образовании из атомов данного неметалла простого вещества каждый атом тоже должен образовывать по три связи за счет спаривания своих р-электронов с р-электронами других таких же атомов.
Наибольшее значение из неметаллов V группы имеют азот и фосфор.
Азот
Химический знак - N. Порядковый номер - 7.
Атомный вес - 14. Строение атома: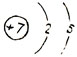
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'