
§ 24. Аммиачная вода
Водородные соединения уже изученных нами неметаллов растворяясь в воде, реагируют с нею с образованием ионов гидроксония. Реагирует с водой при растворении в ней и аммиак, но иначе.
Опустим в кристаллизатор с водой сосуд, наполненный аммиаком, отверстием вниз. Вода быстро заполнит сосуд доверху, то показывает, что аммиак очень хорошо растворяется в воде. В 1 объеме воды ПРИ обычной температуре растворяется до 700 объемов аммиака. Водный раствор аммиака называется аммиачной водой.
Водородные соединения изученных вами неметаллов диссоциируют в растворе, как кислоты. Исследуем и аммиачную воду при помощи прибора для обнаружения электропроводности растворов (рис. 1). При погружении в нее электродов лампочка засветится. Следовательно, в растворе содержатся ионы
Какие же ионы образуются при растворении аммиака в воде. Прильем к раствору несколько капель раствора фиолетового лакмуса или фенолфталеина: в аммиачной воде лакмус окрашивается не в красный цвет (как в растворах галогеноводородов, сероводорода), а в синий, фенолфталеин - в малиновый цвет. Мы обнаружили присутствие в аммиачной воде ионов гидроксила ОН-. Откуда они появились? Молекулу аммиака можно рассматривать, как ион азота 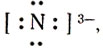 к которому за счет трех электронных пар присоединены три протона
к которому за счет трех электронных пар присоединены три протона 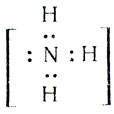
Одна электронная пара при атоме азота остается свободной, не участвующей в образовании химической связи. Молекулу же воды мы уже рассматривали как ион кислорода 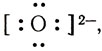 к которому за счет двух электронных пар присоединено 2 протона
к которому за счет двух электронных пар присоединено 2 протона
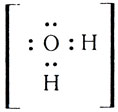
Не участвуют в образовании связей у атома кислорода две электронные пары. Атомы неметаллов в таких водородных соединениях могут за счет свободных электронных пар связывать дополнительные ионы Н+ (вспомните ион гидроксония).
Трехзарядный ион азота в молекуле аммиака сильнее удерживает связанные с ним протоны и сильнее притягивает добавочный протон, чем двухзарядный ион кислорода в молекуле воды. Поэтому при взаимодействии аммиака с водой происходит перемещение протонов из молекул воды в молекулы аммиака:
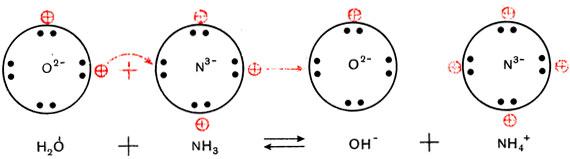
(Кружки с крестиками изображают ионы водорода Н+, или протоны.)
Образуются ионы гидроксила ОН~ и положительно заряженные ионы NH4+, которые получили название "аммоний".
Упрощенно реакция между аммиаком и водой изображается так:
NH3 + H2О 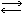 NH4+ + ОH-
NH4+ + ОH-
 NH4+ + ОH-
NH4+ + ОH-Эта реакция обратимая. Лишь малая доля растворенного аммиака присутствует в растворе в виде ионов аммония, большая часть его содержится в виде молекул NH3. Потому аммиачная вода пахнет аммиаком и при стоянии на открытом воздухе или при нагревании выделяет весь растворенный в ней аммиак.
В молекуле аммиака атом азота образует три ковалентные связи, а в ионе аммония - четыре. Но из этих четырех связей по-прежнему лишь три образованы за счет спаривания электронов атома азота с электронами присоединенных атомов. А мы определили валентность именно как число электронов, затраченных рассматриваемым атомом на спаривание с электронами присоединенных атомов. Поэтому валентность азота в зоне аммония, как и в аммиаке, остается равной 3.
Независимо от различного происхождения все 4 связи в зоне аммония совершенно равноценны, и этот ион имеет форму правильной трехгранной пирамиды - тетраэдра.
В медицине и в быту разбавленный раствор аммиака называется аммиачной водой или нашатырным спиртом. Его дают нюхать при обмороке для приведения в сознание. В домашнем хозяйстве он применяется в качестве слабой щелочи при стирке белья и выведении пятен.
В сельском хозяйстве концентрированную аммиачную воду используют в качестве жидкого удобрения.
- Что представляет собой водный раствор аммиака? Какие молекулы и ионы в нем присутствуют? Как эти ионы образуются?
- * Во что превратилась бы молекула метана СН4, если бы в ядро углеродного атома внедрился протон?
- Перед нами стакан, наполненный аммиаком и закрытый пластинкой, и второй открытый стакан. Как "перелить" аммиак из первого стакана во второй, чтобы аммиак по возможности не смешался с воздухом? Как обнаружить результаты опыта, если в нашем распоряжении имеется бумага, пропитанная раствором фенолфталеина?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'