
§ 25. Соли аммония
Свойство молекул аммиака связывать протон должно проявляться не только в отношении аммиака к воде, но и в других химических свойствах аммиака. Нужно ожидать, что особенно легко связывание молекулами аммиака протонов будет происходить при взаимодействии аммиака с кислотами как веществами, содержащими особенно слабо связанные протоны. Нальем в колбу немного аммиачной воды, а в U-образную трубку немного раствора азотной кислоты (рис. 13). При нагревании аммиачной воды из нее выделяется газообразный аммиак. Он растворяется в азотной кислоте. Выясним, что образовалось в U-образной трубке. Для этого поместим часть раствора на часовое стекло и осторожно выпарим воду. На стекле выделились кристаллы соли. Это - нитрат аммония:
NH3 + HNO3= [NH4]+[N03]-
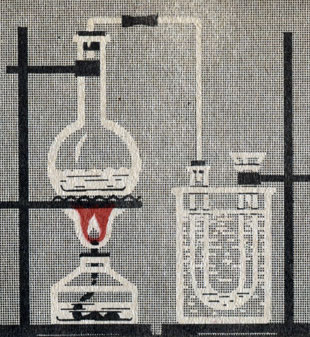
Рис. 13. Образование нитрата аммония
Соли аммония образуются и непосредственным соединением аммиака с соответствующей кислотой в отсутствие воды. Приблизим друг к другу две стеклянные палочки (или два комка бумаги), смоченные одна концентрированной аммиачной водой, другая - концентрированной соляной кислотой. Между ними появится обильный белый дым (рис. 14). Этот дым состоит из мельчайших кристалликов хлорида аммония:
NH3 + HCl = NH4Cl
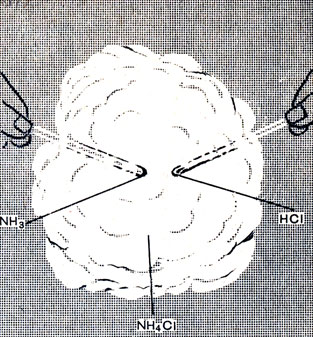
Рис. 14. Образование дыма хлорида аммония
Аммиак соединяется с кислотами с образованием солей
Как все соли, соли аммония построены из ионов и кристаллизуются в ионной решетке, например нитрат аммония - из ионов NH4+ и NO3-. По внешнему виду аммонийные соли представляют кристаллические вещества, очень похожие на соответствующие соли щелочных металлов, но особенно на соли калия, так как радиус иона аммония близок к радиусу иона калия. Численные значения всех физических свойств растворов аммонийных солей при одинаковой концентрации (в молях соли на литр раствора) близки к соответствующим солям калия подобно солям щелочных металлов, все соли аммония в воде растворимы и являются сильными электролитами, т. е. в водном растворе нацело диссоциируют на ионы, например:
NH4NO3 = NH4+ + NO3-
Поэтому соли аммония должны вступать в реакции обмена с другими солями. Так, приливая к раствору хлорида аммония раствор нитрата серебра, мы получаем осадок хлорида серебра, а в растворе нитрат аммония:
NH4Cl + AgNO3 = AgCl↓ + NH4NO3
или в ионной форме ...?
Нитрат аммония можно выделить в виде кристаллов, если отфильтровать хлорид серебра и выпарить раствор.
Ионы аммония при реакциях обмена между солями не разрушаются, а переходят без изменения в состав судной из вновь образующихся солей. Таким образом, в реакциях, не сопровождающихся разрушением аммонийного иона, соли аммония ведут себя так же, как и все другие соли.
Со щелочами соли аммония взаимодействуют иначе, чем другие соли. При приливании к раствору любой соли аммония (или твердой соли) раствора щелочи должна была бы получиться гидроокись аммония. Например:
NH4Cl + NaOH = NH4OH + NaCl
Но гидроокись аммония - вещество неустойчивое, и она разлагается на воду и аммиак:
NH4OH  NH3 + H2O
NH3 + H2O
 NH3 + H2O
NH3 + H2OПоэтому при взаимодействии солей аммония со щелочами получается новая соль, аммиак и вода:
NH4Cl + NaOH = NH3↑ + NaCl + H2O
Учитывая только частицы, подвергнувшиеся изменению, реакцию можно выразить следующим ионным уравнением:
NH4+ + OH- = NH3 + H2O
Полученное уравнение выражает следующее общее свойство аммонийных солей: все соли аммония разлагаются щелочами с выделением аммиака.
Свойство солей аммония отщеплять при действии на них щелочей аммиак используется для получения аммиака в лаборатории. Это же свойство используют для распознавания солей аммония. В пробирку с испытуемой солью или ее раствором приливают раствор щелочи и смесь подогреваю. По запаху или по посинению смоченной водой красной лакмусовой бумажки, которую подносят к отверстию пробирки, заключают, происходит ли выделение аммиака. Если аммиак выделяется, то, значит, в растворе соли содержались ионы аммония.
Ионы аммония могут разрушаться также при нагревании аммонийных солей. При нагревании в пробирке кристаллического хлорида аммония (нашатыря) NH4Cl он возгоняется, подобно иоду (рис. 15). Но возгонка иода относится к физическим явлениям, а возгонка хлорида аммония - к обратимым химическим реакциям. При нагревании хлорид аммония разлагается на хлористый водород и аммиак:
NH4Cl  NH3 + HCl
NH3 + HCl
 NH3 + HCl
NH3 + HCl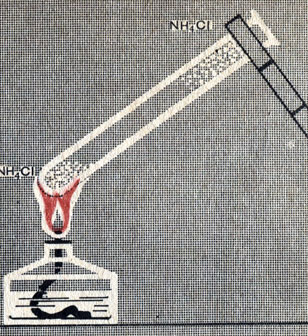
Рис. 15. Возгонка хлорида аммония
Аммиак и хлористый водород улетучиваются, а соприкасаясь с холодными стенками пробирки, снова соединяются:
NH3 + HCl NH4 Cl
NH4 Cl
 NH4 Cl
NH4 Cl
- Напишите формулы: а) бромида аммония, б) сульфита аммония, в) сульфида аммония, г) сульфата аммония.
- Укажите способы получения аммонийных солей, напишите уравнения реакции.
- Опишите общие: а) физические, б) химические свойства солей аммония. Приведите уравнения соответствующих реакций.
- Как опытным путем доказать, что исследуемое вещество: а) хлорид аммония, б) сульфат аммония?
- * Существует азотсодержащее соединение, в котором на 1 атом азота приходится 1 атом серы, 5 атомов водорода и 4 атома кислорода. При действии на раствор этого соединения щелочи выделяется аммиак, а при действии раствором хлорида бария выпадает осадок нерастворимый в соляной кислоте. Что это за соединение и как оно Называется? Как окрашивается лакмус в его растворе? Ответ подтвердите приведением ионных уравнений упомянутых реакций.
- Дана смесь фторида аммония и песка. В вашем распоряжении а) нагревательный прибор или б) вода и лабораторное оборудование. Какими двумя способами можно разделить смесь? Напишите уравнения реакций, которыми вы воспользуетесь.
- Почему белый дым получается более обильный, если бумажку смоченную соляной кислотой, держать над бумажкой, смоченной аммиачной водой, а не наоборот?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'