
§ 48. Окись углерода
Углерод образует два окисла: окись СО и двуокись СО2.
Окись углерода СО - бесцветный газ, без вкуса, чрезвычайно ядовитый. Электронная формула окиси углерода 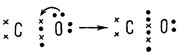 Из нее видно, что в образовании химических связей с кислородом со стороны атома углерода (его валентные электроны обозначены крестиками) участвуют лишь два валентных электрона из четырех.
Из нее видно, что в образовании химических связей с кислородом со стороны атома углерода (его валентные электроны обозначены крестиками) участвуют лишь два валентных электрона из четырех.
В этой электронной формуле учтены лишь ковалентные связи, образованные путем спаривания электронов атома С (изображены крестиками) с электронами атома О (изображены точками). Обратим понимание, что теперь во внешнем слое атома углерода недостает до его завершения двух электронов, и вспомним, что ковалентные связи могут возникать не только путем спаривания электронов, но и путем предоставления одним атомом другому готовой пары электронов. У атома кислорода имеются две свободные пары электронов. Одна из них смещается к атому углерода, дополняя его внешний слой до восьми, и становится третьей ковалентной связью между атомами углерода и кислорода:
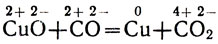
В образовании ее электроны углеродного атома не участвуют, поэтому он остается двухвалентным (как остается трехвалентным азот при превращении молекулы аммиака в ион аммония).
За счет добавочной электронной пары внешний слой атома углерода становится завершенным, и молекула СО получает такое же строение, как молекула азота. Поэтому все физические свойства окиси углерода и азота оказываются очень близкими.
За счет остающихся у атома углерода в окиси углерода неиспользованных на образование связей двух электронов атом углерода может образовать еще две ковалентные связи, присоединяя второй атом кислорода. Это проявляется в двух химических свойствах окиси углерода: она горюча и может восстанавливать металлы из их окислов. Окись углерода горит синим пламенем, превращаясь в двуокись углерода СО2:
2СО + О2 = 2СО2 + 135 ккал
Окись углерода восстанавливает из окислов большинство металлов. Так, при пропускании окиси углерода через нагреваемую трубку с окисью меди черная окись меди превращается в красную порошкообразную металлическую медь:
Cu2+O2- + C2+O2- = Cu0 + C4+О22-
Окись углерода не реагирует ни с водой, ни с растворами щелочей и кислот. Подобно окиси азота, она относится к безразличным, или несолеобразующим, окислам.
Окись углерода получается при взаимодействии двуокиси углерода с сильно раскаленным углем:
C + CO2 2CO - 41 ккал
2CO - 41 ккал
 2CO - 41 ккал
2CO - 41 ккалВ этом можно убедиться, заглянув в жарко растопленную печь. Над раскаленными добела углями вспыхивают голубые огоньки. Это пламя окиси углерода, сгорающей в поступающем через открытую дверцу печи воздухе. Когда угли несколько остынут, голубые огоньки исчезают: реакция между углем и двуокисью углерода прекратилась и окись углерода перестала получаться. Это объясняется тем, что реакция обратима и при этом эндотермична. Возникающее при взаимодействии угля с двуокисью углерода химическое равновесие при очень высоких температурах (примерно выше 1000°С) практически нацело смещено в сторону прямой реакции, т, е. двуокись углерода почти полностью превращается в окись углерода. При пониженных же температурах (примерно ниже 400°С), наоборот, равновесие почти полностью смещено в сторону обратной реакции - распада окиси углерода на уголь и двуокись углерода, и окись углерода перелетает получаться. Теперь понятно, почему сильно раскаленный уголь сгорает с синим пламенем, а слабо раскаленный - без пламени.
Окись углерода содержится в некоторых видах газообразного топлива, а именно в генераторном газе. Генератор, в котором получают эти топлива, представляет печь, загружаемую толстым слоем твердого топлива, например кокса (рис. 33). Снизу в газогенератор подается воздух. В нижнем слое топливо сгорает, и углерод превращается в двуокись углерода:
С + О2 = СО2 + 94 ккал
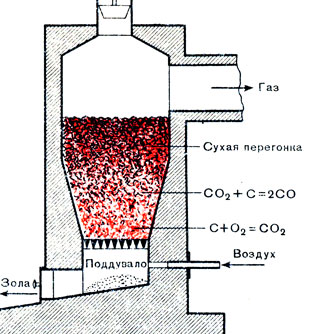
Рис. 33. Схема газогенератора
Двуокись углерода, просачиваясь вместе с азотом через слой раскаленного кокса, восстанавливается в окись углерода:
СО2 + С = 2СО - 41 ккал
Получается газ, состоящий из окиси углерода и азота, а также некоторого количества СО2 и других примесей. Эта горючая смесь и называется генераторным газом.
Если вместо кокса, т. е. свободного углерода, в газогенераторе используются другие виды твердого топлива, например древесина, то в нем происходят те же реакции, так как древесина уже в верхнем слое превращается в уголь в результате сухой перегонки. В этом случае к генераторному газу примешиваются летучие и горючие продукты сухой перегонки.
Превращение твердого топлива в газообразное носит название газификации.

- Опишите: а) получение, б) свойства окиси углерода. Приведите ? А уравнения реакций.
- Что такое генераторный газ? Напишите уравнение реакции его получения.
- Опишите устройство и действие газогенератора.
- На сколько больше энергии получается при образовании каждой грамм-молекулы двуокиси углерода из угля и кислорода, чем расходуется на последующее превращение в окись углерода?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'