
§ 49. Двуокись углерода
Двуокись углерода СO2 - бесцветный газ. Она тяжелее воздуха, и ее можно переливать из сосуда в сосуд, как если бы двуокись углерода была невидимой жидкостью. При опрокидывании стакана с двуокисью углерода над чашечкой с горящим спиртом (рис. 34) двуокись углерода "проливается" на пламя и оно мгновенно гаснет.

Рис. 34. Гашение пламени двуокисью углерода
Двуокись углерода сравнительно легко сжижается. При испарении жидкой двуокиси углерода поглощается так много теплоты, что часть двуокиси углерода затвердевает, превращаясь в белый порошок, подобный снегу.
Двуокись углерода довольно мало растворима в воде. Она не горит и не поддерживает горения обычных горючих веществ.
Двуокись углерода проявляет свойства кислотного окисла, или ангидрида. При пропускании ее в раствор известковой воды раствор мутится из-за выпадения в осадок карбоната кальция:
Са2+ + 2ОН- + СО2 = СаСО3 ↓ + Н2О
Эта реакция настолько характерна, что известковая вода, как вам известно, применяется для обнаружения двуокиси углерода.
В природе двуокись углерода образуется при дыхании животных и растений и при гниении органических остатков в почве. Вследствие этого почвенный воздух беднее кислородом, чем атмосферный. Он тяжелее атмосферного воздуха и поэтому может скопляться в опасных концентрациях в погребах и колодцах. В угольных шахтах из-за медленного окисления угля содержание двуокиси углерода также выше, чем на открытом воздухе. Охрана труда следит, чтобы оно не превышало предельной установленной нормы (0,5% по объему).
Для растений двуокись углерода служит источником углерода, и обогащение ею воздуха в парниках и теплицах приводит к повышению урожая.
Двуокись углерода применяется также для газирования воды и напитков, в жидком виде - в огнетушителях и пожарных машинах. Прессованная твердая двуокись углерода под названием сухого льда применяется в холодильных установках. Преимущество сухого льда перед обыкновенным заключается в том, что он поддерживает в окружающем пространстве значительно более низкую температуру и испаряется, не переходя в жидкое состояние.
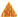
- Опишите: а) физические, б) химические свойства двуокиси углерода, ,в) известные вам применения ее в разных физических состояниях, г) способ обнаружения, д) нахождение в природе.
- Перечислите известные вам источники образования двуокиси углерода в природе, быту и промышленности.
- * Элементы А и Б образуют между собой два соединения В и Г разного состава. Вещество В горючее, а вещество Г негорючее, но превращается в горючее при соединении с веществом А. Что такое А, Б, В, Г? Напишите уравнения упоминаемых в задаче реакций и оговорите условия, при которых каждая из них протекает.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'