
§ 50. Угольная кислота и ее соли
Молекулярная формула угольной кислоты Н2СО3, а ее структурная формула
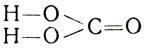
Растворяясь в воде, двуокись углерода частично соединяется с нею, образуя угольную кислоту:
СО2 + Н2О Н2СO3
Н2СO3
 Н2СO3
Н2СO3Эта реакция обратима, так как угольная кислота - соединение крайне непрочное и легко разлагается на ангидрид и воду. Поэтому равновесие в растворе очень сильно смещено в сторону обратной реакции.
Водный раствор двуокиси углерода широко известен под названием газированной воды. Кислый вкус ее едва ощущается: угольная кислота относится к чрезвычайно слабым кислотам. В этом легко убедиться, погрузив в дистиллированную воду электроды от прибора для обнаружения электропроводности и пропустив через воду двуокись углерода. Лампочка не загорится - настолько мало диссоциирована угольная кислота на ионы, Лакмус она окрашивает не в красный, а лишь в розовый цвет и вступает в реакцию с окислами и гидроокисями только наиболее резко выраженных металлов.
Как двухосновная, угольная кислота образует два ряда солей: средние и кислые. Средние соли угольной кислоты называются карбонатами (например, СаСO3 - карбонат кальция), а кислые - бикарбонатами (например, Са(НСO3)2 - бикарбонат кальция). Из средних солей ее растворимы лишь карбонаты щелочных металлов и аммония.
Карбонаты и бикарбонаты распознают действием сильных кислот: происходит характерное "вскипание" вследствие бурного выделения двуокиси углерода:
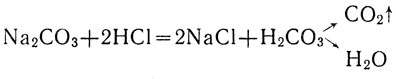
Это испытание удается и с твердыми карбонатами и с их растворами. В ионном виде реакция выражается уравнением:
СO32- + 2Н+ = СO2 ↑ + Н2O
Так как при взаимодействии карбонатов с кислотами происходит связывание ионов водорода, карбонатами, как и основаниями, можно пользоваться для нейтрализации кислот. Так, известняк СаСО3 в размолотом виде применяется для известкования почв при излишней их кислотности.
Из-за слабости угольной кислоты карбонаты в водном растворе гидролизуются, и их растворы обладают сильной щелочной реакцией:
СО32- + Н2О НСO3- + ОН-
НСO3- + ОН-
 НСO3- + ОН-
НСO3- + ОН-Наиболее распространен из природных карбонатов карбонат кальция. Залежи пород, его содержащих, встречаются часто. Поэтому одной из задач краеведческой работы в районах с кислыми почвами должны быть поиски таких пород.
Из искусственно получаемых карбонатов большое народнохозяйственное значение имеет карбонат натрия Nа2СО3, известный под названием соды. Сода применяется для производства мыла, стекла, а в быту - для стирки белья.
При насыщении раствора соды двуокисью углерода она переходит в бикарбонат натрия NaHCO3.
Бикарбонат натрия продается в аптеках и продовольственных магазинах под названием питьевой воды. Он принимается внутрь при изжоге, вызванной избытком в желудочном соке соляной кислоты.
Питьевая сода применяется в кондитерском деле, хлебопечении и в огнетушителях как источник двуокиси углерода. Она входит в состав хлебопекарных порошков, добавляемых к тесту. Такое тесто всходит без применения дрожжей и заквасок, наполняясь пузырьками двуокиси углерода, и выпеченный из него продукт получается пористым, мягким, вкусным и легче переваривается. Двуокись углерода образуется за счет реакции:
2NaHCO3 = Na2CO3 + H2O + CO2↑
Пенные огнетушители наполняют концентрированным раствором питьевой соды, к которому добавляют вещества, образующие пену, а в верхней части помещают заполненный сосудик с концентрированной серной кислотой. Для приведения в действие огнетушитель переворачивают и ударяют об пол металлическим штифом (рис. 35). Сосудик с кислотой разбивается, и она вступает в реакцию с бикарбонатом. Образующаяся двуокись углерода вспенивает жидкость и выбрасывает ее из огнетушителя сильной струей. Пенистая жидкость и двуокись углерода обволакивают горящий предмет, оттесняют воздух и гасят пламя.
Рис. 35. Огнетушитель. а - заряженный, б - в действии
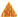
- Напишите: а) электронную и структурную формулу угольной кислоты, б) формулы карбонатов и бикарбонатов калия, магния. Назовите их.
- Раствор соды добавили к растворам: а) едкого натра, б) гидроокиси кальция, в) серной кислоты, г) нитрата калия, д) хлорида магния. В каких случаях будет наблюдаться реакция? Напишите ионные уравнения этих реакций.
- Улавливание двуокиси углерода на известковообжигательных заводах производится путем пропускания топочных газов через раствор карбоната калия. После насыщения двуокисью углерода раствор нагревается и отдает поглощенную им двуокись углерода. Напишите уравнения происходящих при этом реакций.
- * Придумайте простейший способ определения процентного содержания карбоната кальция в высушенном образце почвы (не содержащей других карбонатов). Способ должен включать не более двух взвешиваний. Предполагается, что почва освобождена от растворимых в воде соединений и не содержит нерастворимых фосфатов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'