
§ 56. Кислородные соединения кремния
Окисел кремния SiO2 называется кремнеземом. В отличие от двуокиси углерода, кремнезем - твердое, очень тугоплавкое вещество. Резкое различие свойств СO2 и SiO2 объясняется разным строением их кристаллических решеток. Двуокись углерода кристаллизуется в молекулярной решетке, слагающейся из слабосвязанных межмолекулярными силами молекул СO2, а двуокись кремния - в атомной решетке, структурная формула которой может быть изображена так:
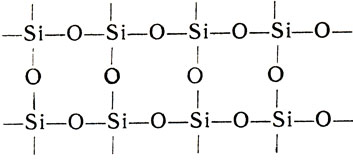
Причина такого различия строения двуокисей углерода и кремния заключается в неодинаковости радиусов атомов этих элементов. Атом углерода настолько мал, что может разместить около себя только два атома кислорода, предоставляя каждому по две единицы валентности, т. е. образуя молекулу O = С = O. Атом же кремния размещает 4 атома кислорода, предоставляя каждому по одной единице валентности, вторая же единица валентности атомов кислорода затрачивается на присоединение следующих атомов кремния. Поэтому и образуется вместо молекулярной атомная решетка. Каждый атом кремния оказывается заключенным в тетраэдр из 4 атомов кислорода не только в кремнеземе, но и во всех других кислородных соединениях кремния - кремниевых кислотах и их солях.
В природе кремнезем встречается в виде включений в граниты и другие породы. Такие включения выглядят на осколках породы как кусочки сплавленного стекла. Освобождаясь при выветривании породы, они скопляются в руслах рек в виде белого песка. Встречается двуокись кремния и в виде прекрасных кристаллов, величиной иногда превышающих человеческий рост (рис. 43).

Рис. 43. Природный кристалл кварца
Кристаллический кремнезем называется кварцем. При плавлении кварц размягчается постепенно и так же постепенно при охлаждении затвердевает. Это облегчает изготовление из кварца изделий, например химической посуды. Кварц очень мало расширяется при нагревании. Поэтому кварцевую посуду можно, раскалив добела, бросить в холодную воду, и она не трескается.
Двуокись кремния относится к ангидридам. Но она не соединяется с водой: реки веками текут по руслу из двуокиси кремния, а продукта соединения ее с водой в речной воде не обнаруживается. Кислотный характер двуокиси кремния проявляется при сплавлении ее с окислами металлов, щелочами и карбонатами. При этом образуются соли кремниевой кислоты:
2NaOH + SiО2 = Na2SiО3 + H2О
Кремниевую кислоту можно получить, лишь действуя на растворы ее солей кислотами, например:
2Na+ + SiО32- + 2H+ + SО42- = H2SiО3↓ + 2Na+ + SO42-
Она выпадает в виде студенистого осадка, которому условно приписывается формула Н2SiO3. В действительности осажденная кремниевая кислота - это смесь сплетенных друг с другом в рыхлые клубки молекул примерно такого строения:
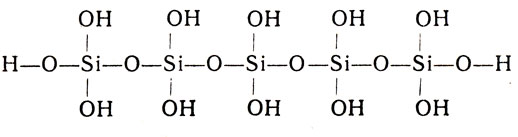
Каждый атом кремния опять-таки оказывается в этих молекулах заключенным в тетраэдр из 4 атомов кислорода. Подобно угольной кислоте, кремниевая кислота - непрочное соединение и постепенно разлагается на воду и кремниевый ангидрид:
H2SiO3 = SiO2 + H2O
Подобно угольной кислоте, кремниевая кислота чрезвычайно слабая кислота.
Соли кремниевой кислоты называются силикатами. Из силикатов, как и из карбонатов, растворимы лишь соли щелочных металлов. Поэтому силикаты щелочных металлов называются растворимыми стеклами.

- Перечислите физические свойства двуокиси кремния, объясните их отличие от физических свойств двуокиси углерода и перечислите известные вам применения двуокиси кремния.
- Опишите химические свойства двуокиси кремния.
- Опишите физические, химические свойства и получение кремниевой кислоты. В чем сходна и чем отличается она от угольной кислоты?
- Какие соли кремниевой кислоты растворимы в воде и как они называются?
- Белый песок растворили кипячением с раствором вещества X, окрашивающего пламя в желтый цвет, прибавили к раствору соляную кислоту, выпал студенистый осадок. Запишите уравнения этих реакций.
- *Как, исходя из кремния, получить кремниевую кислоту? Напишите уравнения реакций.
- *Как кристалл кварца посредством нескольких последовательных реакций превратить в пористую двуокись кремния - силикагель?
- Написать уравнение реакции (в ионной форме) гидролиза силиката натрия.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'