
§ 57. Коллоидные растворы
На примере кремниевой кислоты нам предстоит познакомиться с особым видом растворов, которые получили название коллоидных растворов.
Вам известны два способа распределения одного вещества в другом: взвеси и растворы. Поваренная соль при смешивании с водой образует прозрачный раствор, а мел или глина - мутную взвесь. Взвешенные в растворителе частички твердого вещества образуют суспензию, а мельчайшие капельки жидкости - эмульсию. Примером эмульсии служит молоко (рис. 44). Взвеси неустойчивы: содержащиеся в них частички постепенно, в зависимости от плотности, оседают на дно сосуда или всплывают наверх (так получаются из молока сливки).
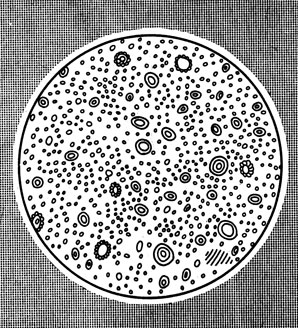
Рис. 44. Молоко под микроскопом
Разница между растворами и взвесями заключается в размерах частиц, распределенных в растворителе (рис. 45). Промежуточное положение между истинными растворами и взвесями занимают коллоидные растворы. Коллоидные растворы - это взвеси, которые содержат настолько маленькие частицы, что жидкость может казаться прозрачной, хотя частички представляют собой не отдельные молекулы, а скопление их. Такие вещества, как кремниевая кислота Н2SiO3, гидроокись железа (III), нерастворимы в воде, и истинные растворы их получить невозможно. Но можно получить их коллоидные растворы в виде совершенно прозрачной жидкости.
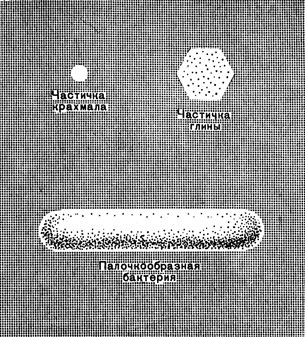
Рис. 45. Сравнительные размеры коллоидных частиц
В кипящую воду будем добавлять капля за каплей раствор хлорида железа (III). Он желтоватого цвета, а получится прозрачная жидкость темно-коричневого цвета. Это - коллоидный раствор гидроокиси железа, образовавшийся вследствие гидролиза хлорного железа:
FeCl3 + 3HOH = Fe(OH)3↓ + 3HCl
или в ионной форме:
Fe3+ + 3H2O = Fe(OH)3↓ + 3H+
Яичный белок тоже коллоидный раствор. Клей, желатин, крахмал при нагревании с водой тоже образуют коллоидные растворы. Слово "коллоид" произошло от греческого названия клея "колла" и означает "подобный, клею".
Как распознавать коллоидные растворы, если они так же прозрачны, как истинные растворы? Взвешенные частички в коллоидном растворе можно обнаружить подобно тому, как обнаруживается присутствие пылинок в комнатном воздухе. Когда в темную комнату проникает сквозь щель солнечный луч, то, глядя сбоку, его можно увидеть в виде светлой "дорожки", образованной рассеивающими свет пылинками. Точно так же, если в затененном помещении пропускать световой луч через коллоидный раствор, например полученной нами гидроокиси железа, и глядеть на раствор сбоку, то путь луча в растворе можно наблюдать в виде такой же светлой "дорожки" вследствие рассеяния света коллоидными частичками (рис. 46). При прохождении светового луча через истинный раствор (например, сахара или поваренной соли) такого явления не наблюдается, хотя бы раствор имел окраску: содержащиеся в истинных растворах молекулы или ионы слишком малы и заметно не рассеивают света. Однако резкой границы ни между взвесями и коллоидными растворами, ни между коллоидными и истинными растворами нет. Известны вещества, например белки, молекулы которых настолько крупны, что они образуют коллоидные растворы, хотя и находятся в них в состоянии молекулярного раздробления.

Рис. 46. Прохождение луча света через коллоидный (а) и через истинный (б) растворы
Коллоидные частички, сколько бы времени раствор ни стоял в покое, не оседают на дно сосуда. Они находятся в постоянном движении вследствие беспрерывных ударов о них молекул растворителя. Это препятствует их осаждению.
Почему коллоидные частички, находясь в беспрерывном движении и все время встречаясь друг с другом, не слипаются? Слипанию коллоидных частиц препятствует наличие у них электрического заряда - у одних коллоидов положительного, у других - отрицательного. Заряд у коллоидных частиц возникает либо вследствие отщепления ими со своей поверхности ионов того или иного знака в раствор (как при диссоциации электролитов), либо вследствие адсорбции поверхностью коллоидных частичек ионов того или другого знака из раствора. Так, ют частичек гидроокиси кремния, как кислоты, отщепляются раствор ионы водорода, и частички получают отрицательный заряд. От частичек гидроокиси железа (III), как основания, отщепляются с поверхности в раствор ионы гидроксила, и они получают положительный заряд. Так как коллоидные частички в данном растворе заряжены одноименно, они взаимно отталкиваются, а поэтому не могут притянуться друг к другу и образовать более крупные частицы. Но если к коллоидному раствору прилить раствор какого-либо электролита, например к коллоидному раствору гидроокиси железа (III) добавить несколько капель раствора сульфата аммония (NH4)2SО4, то быстро выпадет коричневый осадок гидроокиси железа (III). Это происходит потому, что коллоидные частички, притягивая противоположные им по знаку заряда ионы SО42-, нейтрализуются и, утратив заряд, могут теперь беспрепятственно сближаться друг с другом и слипаться в более крупные частицы, выпадающие в осадок.
Соединение коллоидных частичек в более крупные частицы называется коагуляцией. Чем больше заряд адсорбирующихся ионов, тем меньшая концентрация их достаточна, чтобы вызвать коагуляцию.
Часто при коагуляции коллоидные растворы образуют обычные осадки, но иногда не происходит отделения коллоидных частиц от растворителя, а коллоидный раствор весь превращается в полутвердую упругую массу, называемую студнем, как это происходит при застудневании крахмального клейстера (киселя) или раствора желатина при образовании желе.; Студень получается также при коагуляции клея. Студень клея при испарении из него воды все более твердеет и может прочно склеивать предметы. При варке яиц вкрутую тоже происходит коагуляция белков, приводящая к образованию студня. То же самое происходит с белками крови при ее свертывании.
В природе коагуляция происходит, например, когда пресные воды рек, несущие разнообразные вещества в коллоидном состоянии, встречаются с морской водой, богатой солями. Вследствие коагуляции коллоидов в устьях рек образуются отложения ила и появляются мели.
Коллоидные растворы играют важную роль в природе и в производстве. Коллоидными растворами богаты почвы, и явления, происходящие в этих растворах, влияют на плодородие почв. Протоплазма всех живых клеток, кровь представляют собой коллоидные растворы. С получением коллоидных растворов, их коагуляцией, образованием студней связаны также промышленные процессы, как изготовление клеев, лаков, крашение тканей, дубление кож, получение искусственных волокон и т. д.

- Что называется: а) коллоидным раствором, б) суспензией, в) эмульсией?
- Укажите черты сходства и различия: а) взвесей и коллоидных растворов, б) коллоидных и истинных растворов.
- Как показать на опыте, что раствор мыла в воде - коллоидный раствор, а раствор сахара - истинный?
- Что такое коагуляция? Что противодействует коагуляции и как ее можно вызвать?
- Что произойдет при сливании коллоидных растворов, частички которых несут заряды противоположного знака?
- В парикмахерских при порезе кожи, чтобы остановить кровь, ранку натирают квасцовым камнем - кристаллом состава KAl(SО4)2*12H2О. Объясните, что при этом происходит, зная, что коллоидные частицы кровяных белков заряжены отрицательно.
- Какого из электролитов: Al(NО3)3, Na2SО4, СаСl2 требуется меньше всего, чтобы вызвать коагуляцию: а) положительно заряженного, б) отрицательно заряженного коллоида?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'