
§ 61. Физические свойства металлов
Кристаллические решетку металлов сходны с атомными решетками. Но в атомных решетках связи между атомами ковалентные, а в металлах мы встречаемся с новым видом химической связи: металлической связью. Валентные электроны не закреплены в металлах каждый за своим атомом или своей парой атомов (как в ковалентных связях), а могут отщепляться от атомов и свободно блуждать между ними. Такие электроны осуществляют связь между ионами металла, наподобие прослойке воды между сложенными вместе пластинками: она позволяет перемещать пластинки относительно друг друга, но сопротивляется отрыванию одной пластинки от другой. Из такого внутреннего строения металлов проистекают их характерные, общие физические свойства:
- Пластичность. При деформации, т. е. изменении формы куска металла, происходит смещение пластов из ионов относительно друг друга, но разрыва не происходит, так как связывающие их электроны, соответственно переместившись, продолжают осуществлять связь между сместившимися ионами.
- Электропроводность. Она обусловливается свободой перемещения электронов, поскольку они не закреплены каждый за своим атомом, по всему куску металла.
- Высокая теплопроводность. Переносчиками тепловой энергии из одного участка в куске металла в другой являются главным образом те же электроны.
Они же являются причиной общих оптических свойств неметаллов - непрозрачности и металлического блеска.
По металлическому блеску мы узнаем металлы и их сплавы среди других веществ. Металлы блестят потому, что отражают от своей поверхности световые лучи, а не пропускают их, как стекло, и почти не поглощают, как сажа.
Металлы отражают не только видимый свет, но и невидимые радиоволны. Это свойство металлов используется в радиотелескопах, улавливающих радиоизлучения космоса, и в радиолокаторах, обнаруживающих самолеты на расстоянии сотен километров от наблюдателя.
Будучи общими всем металлам, перечисленные свойства проявляются у них в неодинаковой степени. Так, металлический блеск наиболее ярко проявляется у серебра; оно и применяется в производстве зеркал. Смотрясь в зеркало, мы видим свое отражение от тончайшего слоя серебра, нанесенного на заднюю поверхность стеклянной пластинки.
По электропроводности первое место среди всех веществ занимает то же серебро, к нему примыкают медь и алюминий. В электротехнике из-за дороговизны серебра в качестве материала для электропроводки используются медь и алюминий. Без этих металлов невозможно было бы передавать электрическую энергию на расстояния в десятки, сотни километров от вырабатывающей ее электростанции лишь с незначительными потерями в пути.
Электропроводность остальных металлов изменяется в очень широких пределах. Например, у вольфрама она в 340 раз меньше, чем у серебра. Техника нуждается и в таких металлах с умеренной электропроводностью. Они необходимы в электронагревательных устройствах. Нить накала электролампочки нагревается за счет сопротивления, оказываемого ею электрическому току, поэтому для изготовления ее нужен металлический материал с малой электропроводностью. Сейчас нити накала изготовляются главным образом из вольфрама.
Теплопроводность чистых металлов пропорциональна их электропроводности. Поэтому по теплопроводности металлы располагаются в такой же ряд как и по электропроводности: серебро, за ним следуют медь и алюминий, далее прочие металлы.
Основное механическое свойство металлов - пластичность - на практике проявляется в том, что под ударами молота металлы не дробятся на куски, а расплющиваются - они ковки. Первое место среди металлов по ковкости занимает золото. Его можно прокатывать в тончайшие полупрозрачные листы и вытягивать в тончайшую, невидимую глазом проволоку.
Из неспецифических для металлов физических свойств наибольший практический интерес имеют плотность, температура плавления и твердость.
Плотность металла тем меньше, чем меньше его атомный вес и чем больше радиус атома (почему?). Она у металлов изменяется в очень широких пределах - от 0,5 у лития до 22 у осмия. Металлы с плотностью ниже 5 называются легкими металлами. Из конструкционных металлов к легким относятся магний, алюминий и титан; они используются, главным образом, в строительстве транспорта, титан - в самолетах, летающих со сверхзвуковыми скоростями. Трение о воздух при таких скоростях вызывает сильное разогревание обшивки самолета, а прочность металлов при нагреве сильно снижается, прежде чем станет равной нулю, когда металл расплавится. У титана высокая температура плавления и снижения прочности у него в условиях скоростных полетов, в отличие от алюминиевых сплавов, не происходит.
В тех редких случаях, когда от металлического материала требуется возможно большая плотность (дробь, пули), используется свинец, хотя его плотность примерно вдвое меньше, чем у наиболее тяжелых, но дорогих металлов.
Свойства металлов: температура плавления, прочность, твердость - зависят главным образом от прочности металлической связи. Она у разных металлов неодинакова, и особенно велика у тяжелых металлов с достраивающимся предпоследним электронным слоем атома, поэтому такие металлы отличаются высокой тугоплавкостью и высокой твердостью.
Температуры плавления металлов изменяются в очень широких пределах: от -39°С у ртути до 3410°С у вольфрама. Ртуть как единственный жидкий при обычных условиях металл применяется в измерительных приборах, вольфрам - во всех случаях, когда требуется металлический материал, противостоящий особенно высоким температурам, например для нитей накала электролампочек.
В широких пределах изменяется и твердость металлов: щелочные металлы мягки, как воск, а самые твердые из металлов, к которым относятся вольфрам и хром, не поддаются обработке закаленными напильниками.
К числу общих свойств металлов относится их растворимость друг в друге. Такие растворы металлов называются сплавами. Для каждого металлического изделия и каждой металлической детали подбирается или создается "по заказу" такой материал, который наилучшим образом удовлетворяет назначению изделия или детали. Среди чистых металлов такого материала, в котором сочетались бы все заданные свойства, обычно не находится, и тогда мы обращаемся к сплавам.
Так, в электролампочке, кроме вольфрама и цинка - из него изготовлен цоколь,- мы находим два сплава. Припой - легкоплавкий сплав свинца с сурьмой и оловом, из него состоит контакт лампочки и спай патрона с проволочкой, подводящей ток к нити накала, сама же эта проволочка из платинита - сплава железа с никелем, расширяющегося при нагревании одинаково со стеклом, вследствие чего она может впаиваться в стекло и при нагревании в месте спая не трескается (рис. 49).
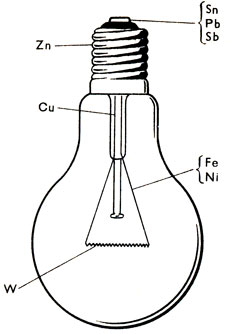
Рис. 49. В состав электролампочки входит семь металлов

- Опишите внутреннее строение металлов и природу металлической связи.
- Перечислите общие физические свойства металлов, объясните их с точки зрения теории строения металлов, назовите металлы, у которых данное свойство проявляется наиболее ярко, и свяжите с ним практическое применение названных вами металлов.
- Назовите самый легкий и самый тяжелый металл; самый легкоплавкий и самый тугоплавкий металл; самые мягкие и самые твердые металлы.
- Где можно встретить в быту: а) вольфрам, б) ртуть, в) медь, г) серебро? На каких физических свойствах данного металла основано применение его в быту?
- Если мгновенно остановить быстро движущийся металлический стержень, то на переднем конце его на мгновение возникает отрицательный, а на заднем положительный заряд. Почему?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'