
§ 62. Электрохимический ряд напряжения металлов
Наиболее общее из общих химических свойств металлов заключается в том, что их атомы, отдавая валентные электроны, обращаются в положительно заряженные ионы:
Na - 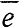 = Na+; Сu - 2
= Na+; Сu - 2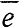 = Сu2+
= Сu2+
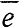 = Na+; Сu - 2
= Na+; Сu - 2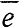 = Сu2+
= Сu2+Изучим это свойство металлов на примере реакций замещения металлов друг другом в солях.
Опустим кусок меди (медную монету, медную проволоку) в раствор какой-либо соли железа, например его сульфата FeSO4. Никакой реакции не происходит: медь не вытесняет железа из его солей. Поступим наоборот: опустим кусок железа - железный нож или гвоздь - в раствор какой-либо соли меди, например ее сульфата CuSO4. Тотчас железо покрывается розовым слоем меди, а голубая окраска раствора, свойственная гидратированным ионам меди, постепенно исчезает, сменяясь зеленоватой окраской гидратированных ионов железа. Железо вытесняет медь из растворов ее солей. Сульфат меди (II) - сильный электролит. В растворе он полностью расщеплен на ионы меди и ионы кислотного остатка, Поэтому ионное уравнение реакции выразится так:
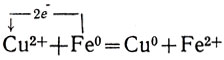
Реакция сводится к перемещению электронов от атомов железа к ионам меди. Железо вытесняет медь потому, что его атомы легче отдают электроны, чем атомы меди. Чем легче атомы металла отдают электроны, тем металл химически активнее. Железо химически активнее, чем медь.
В раствор того же сульфата меди (II) бросим капельку ртути. Реакции не происходит: ртуть не вытесняет меди из растворов ее солей. Вновь поступим наоборот: опустим кусок меди, например медную монету, в раствор какой-либо соли ртути, например Hg(NO3)2. Медная монета тотчас становится похожей по виду на серебряную: на ее поверхности выделяется металлическая ртуть. А бесцветный вначале раствор приобретает знакомую нам голубую окраску гидратированных ионов меди. Медь вытесняет ртуть из растворов ее солей:
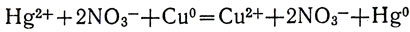
или
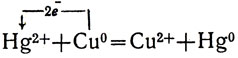
Реакция сводится к перемещению электронов от атомов меди к ионам ртути. Медь, будучи менее химически активным металлом, чем железо, оказывается более активной, чем ртуть.
Таким образом, реакции замещения металла металлом в солях заключаются в перемещении электронов от атомов замещающего - более активного - металла к ионам замещаемого менее активного металла. Такие реакции необратимы: если металл А вытесняет металл Б из раствора его солей, то металл Б не будет вытеснять металл А из растворов его солей.
В порядке убывания химической активности, проявляемой в реакциях вытеснения металлов друг другом из растворов их солей, русский химик Н. Н. Бекетов расположил металлы в ряд, называемый сейчас электрохимическим рядом напряжений. Вот этот ряд:
Na, Са, Mg, Al, Zn, Сr, Fe, Pb, (Н), Сu, Hg, Ag, Au, Pt
Каждый левее стоящий металл в ряду может вытеснять все следующие за ним металлы из растворов их солей, а сам может вытесняться лишь предшествующими ему металлами.
В электрохимический ряд напряжений металлов включен водород как единственный неметалл, разделяющий с металлами общее свойство - образовывать положительно заряженные ионы. Поэтому водород тоже может замещать некоторые металлы в их солях и сам может замещаться многими металлами в кислотах, например:
Zn + 2HCl = ZnCl2 + H2↑
или в виде ионного уравнения:
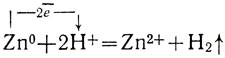
Все металлы, стоящие в электрохимическом ряду напряжений до водорода, вытесняют его из растворов кислот, а все следующие за ним, например медь, не вытесняют.
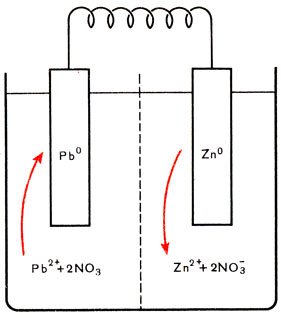
Рис. 50. Схема гальванического элемента
Реакцию замещения металла металлом можно провести и не приводя в соприкосновение второй металл с раствором соли первого металла. Для этого можно погрузить оба металла, например цинк и свинец, в растворы их собственных солей, разделенные пористой перегородкой, и соединить металлы проволокой, как представлено на рисунке 50. Будет происходить та же самая реакция, как и при погружении цинка непосредственно в раствор соли свинца:
Zn0 + Pb2+ = Zn2+ + Pb0↓
В правом отделении цинк будет растворяться, т. е. переходить в раствор в виде ионов Zn2+. Отщепляющиеся при этом от атомов цинка электроны будут перемещаться по проволоке в свинцовую пластинку. Ионы свинца, содержащиеся в растворе, притягиваясь к ней, будут захватывать прибывающие из цинка электроны и превращаться в электронейтральные атомы: свинцовая пластинка будет покрываться новыми слоями металлического свинца. (При этом анионы кислотного остатка через пористую перегородку переходят из левого отделения, в котором катионы убывают, в правое, где катионы накапливаются.) Так как свинцовая пластинка в реакции не участвует, свинец может быть заменен любым другим металлом, не реагирующим с солями свинца, или же углем. Не участвует в реакции и соль цинка. Поэтому она тоже может быть заменена любым другим электролитом, не реагирующим с цинком. Такие устройства, как вам известно из курса физики, называются гальваническими элементами.
Гальванический элемент можно построить из любой пары металлов, погруженных в растворы их солей. Напряжение на полюсах такого элемента будет тем больше, чем дальше удалены друг от друга оба металла в рассматриваемом нами ряду: поэтому он и назван электрохимическим рядом напряжений.
Гальванические элементы создаются и на основе других видов окислительно-восстановительных реакций, например на основе реакции соединения водорода с кислородом:
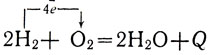
- Даны металлы: алюминий, олово, медь, ртуть, серебро и растворы солей этих же металлов. Напишите в ионной форме уравнения осуществимых реакций между названными металлами и солями.
- В вашем распоряжении сосуд с пористой перегородкой, кусок цинка, кусок угля, медная проволока, соляная кислота и раствор хлорида цинка. Составьте по образцу рисунка схему гальванического элемента из этих материалов, напишите, в ионном виде уравнения реакций, происходящих в левом и правом отделении. В чем заключается разница между результатами проведения данной реакции в аппарате Киппа и в предложенном вами гальваническом элементе?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'