
§ 64. Щелочные металлы
Возобновляя изучение отдельных химических элементов, мы прежде всего возвратимся к металлам с наиболее ярко выраженными металлическими свойствами. Это - щелочные металлы.
В периодической системе они образуют главную подгруппу I группы химических элементов. В атомах щелочных металлов содержится по одному внешнему, или валентному, электрону. Отдавая валентный электрон, их атомы обращаются в однократно положительно заряженные ионы. Во всех своих соединениях щелочные металлы одновалентны и образуют только ионные связи. Из металлов щелочные металлы - самые активные: ими начинается электрохимический ряд напряжений. Гидроокиси щелочных металлов, в том числе известные вам NaOH - едкий натр, или каустическая (в переводе "жгучая") сода, и едкое кали КОН, опасны в обращении. Они разъедают кожу и ткани, поэтому называются едкими щелочами. Подобно гидроокисям, растворимы в воде и все соли щелочных металлов, с которыми приходится нам встречаться; все эти соли относятся к сильным электролитам.
Характерной для щелочных металлов является окраска, придаваемая каждым из них бесцветному пламени. Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество можно внести в пламя горелки на кончике железной проволоки, или булавки, или пера (рис. 51). Окрашивание бесцветного пламени в желтый цвет указывает на присутствие в веществе натрия; соединения калия окрашивают пламя в бледно-фиолетовый цвет.

Рис. 51. Проба на окрашивание пламени
Проволоку предварительно нужно прокаливать до тех пор, пока пламя не перестанет ею окрашиваться в желтый цвет, т. е. пока с ее поверхности не испарятся соединения натрия. Достаточно после прокаливания потереть проволочку о руку и вновь ввести в пламя, чтобы желтое окрашивание появилось: при трении о кожу проволочка загрязнилась ничтожным количеством соединений натрия, всегда содержащихся в потовых выделениях кожи, и мы это обнаружили.
Желтое свечение паров натрия было использовано при полете одной из советских космических ракет для определения местонахождения ее в момент выбрасывания из нее паров натрия по сигналу с Земли.
С возрастанием порядкового номера щелочных металлов увеличиваются радиусы их атомов, внешний, или валентный, электрон все дальше отодвигается от ядра, заэкранированного внутренними электронами, и связь его с атомом все более ослабляется. Вследствие этого химическая активность щелочных металлов возрастает с возрастанием порядкового номера. Наименее химически активен из них литий (порядковый номер 3), наиболее активны рубидий и особенно цезий (порядковые номера 37 и 55). Электроны из них легко выбрасываются при освещении поверхности металла, создавая электрический ток в устройствах, подобных изображенному на рисунке 52. Такие устройства, соединенные с включателями и выключателями электрического тока, находят все более широкое применение в качестве как бы "органа зрения" машин-автоматов, приводимых в действие, регулируемых и контролируемых световыми сигналами без участия человека.
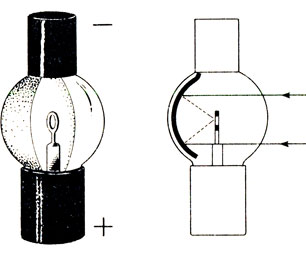
Рис. 52. 'Электрический глаз'. слева - общий вид, справа - в разрезе. Световые лучи изображены сплошными линиями, выбиваемые лучами из цезия электроны - пунктиром
Растворимость гидроокисей щелочных металлов с возрастанием их порядкового номера возрастает, так как из-за увеличения радиуса их атомов увеличивается расстояние между ионами щелочного металла и гидроксила в кристаллической решетке гидроокиси и ослабляется взаимное притяжение этих ионов.
- Охарактеризуйте положение щелочных металлов в периодической системе и в электрохимическом ряду напряжений, строение их атомов, общие химические свойства.
- Как и почему изменяется химическая активность щелочных металлов с возрастанием порядкового номера?
- Охарактеризуйте общие свойства гидроокисей и солей щелочных металлов.
- При поджигании струи водорода, вытекающего из трубки, пламя оказывается бесцветным, если трубка железная, и окрашена в желтый цвет, если трубка стеклянная. О чем свидетельствует желтая окраска пламени во втором случае?
- Напишите уравнения реакций между металлическим натрием и: а) водой, б) соляной кислотой в ионной форме.
- Почему в земной природе не могут встречаться ни щелочные металлы в свободном состоянии, ни их окислы, ни их гидроокиси, а встречаются только их соли? Где эти соли с течением времени накопляются? Напишите в ионной или электронно-ионной форме уравнения реакций, которые с названными веществами (на примере натрия и его соединений, кроме солей) произошли бы, если бы эти вещества в земной природе появились.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'