
§ 66. Кальций
Химический знак - Са. Порядковый номер - 20.
Атомный вес - 40. Строение атома: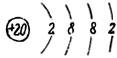
По химической активности и другим химическим свойствам больше всего к щелочным металлам должны приближаться элементы, соседние с ними в периодической системе, образующие главную подгруппу II группы, особенно с большими порядковыми номерами, вследствие этого большими размерами атомов и особенно" слабой связью внешних, или валентных, электронов. От атома соседнего щелочного металла атомы элементов рассматриваемого семейства отличаются лишней единицей положительного заряда ядра и добавочным электроном во внешнем слое. Отдавая оба валентных электрона, они обращаются в двукратно положительно заряженные ионы, поэтому во всех соединениях положительно двухвалентны. В качестве представителя таких металлов рассмотрим кальций.
Отдавая внешние электроны, атом кальция превращается в ион Са2+. Во всех своих соединениях кальций положительно двухвалентен.
Кальций - легкий металл серебристо-белого цвета. Если кусочек кальция нагреть, он сгорает пламенем кирпично-красного цвета с образованием белого дыма. Этот дым образован тончайшими твердыми частичками окиси кальция СаО:
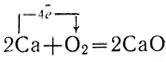
Будучи брошен в воду, кальций реагирует с нею, превращаясь в гидроокись кальция и вытесняя из воды водород:
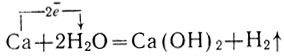
Фенолфталеин в полученном растворе окрашивается в малиновый цвет. Так оправдывается ожидаемое сходство кальция с щелочными металлами: он, как и щелочные металлы, взаимодействует с водой с выделением водорода. Его гидроокись, как и гидроокиси щелочных металлов, растворима в воде, т. е. представляет собой щелочь.
Окись кальция. Окись кальция получают в промышленности обжигом известняка:
СаСО3 = СаО + СО2↑
Окись кальция - тугоплавкое вещество. При смешивании с водой она соединяется с ней с выделением такого большого количества теплоты, что вода закипает. Куски окиси кальция, впитывая воду, разбухают и рассыпаются (рис. 53), превращаясь в тонкий рыхлый порошок гидроокиси кальция:
СаО + Н2O = Са(ОН)2
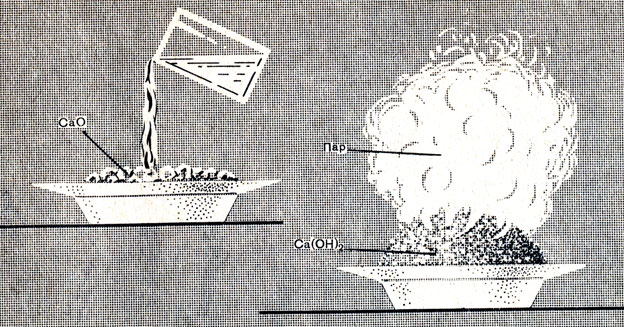
Рис. 53. Гашение извести
В производстве эта реакция называется гашением извести, окись кальция - негашеной известью, а гидроокись кальция - гашеной известью.
Окись кальция, как основной окисел, связывает двуокись углерода, превращаясь в карбонат кальция:
СаО + СO2 = СаСO3
Гидроокись кальция. Гидроокись кальция немного растворима в воде. Ее водный раствор называется известковой водой. В ней гидроокись кальция полностью диссоциирована на ионы:
Са(ОН)2 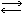 Са2+ + 2OН-
Са2+ + 2OН-
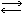 Са2+ + 2OН-
Са2+ + 2OН-Если бросить в воду больше гидроокиси кальция, чем ее может раствориться, то получается белая суспензия частиц гидроокиси кальция в известковой воде - известковое молоко.
Тестообразная смесь гидроокиси кальция с водой, в которую для увеличения объема добавляется песок, применяют в строительстве для скрепления кирпичей и оштукатуривания стен. С течением времени, поглощая из воздуха двуокись углерода, смесь "схватывается", затвердевая в столь прочную массу, что при ломке старых зданий трещины проходят через кирпичи, а не по связывающим их прослойкам. Уравнение реакции "схватывания":
Са(ОН)2 + СO2 = СаСО3↓ + Н2O
Карбонат кальция. Прибавим к известковой воде фенолфталеин (раствор окрасится в малиновый цвет) и будем пропускать в раствор из аппарата Киппа углекислый газ. Прозрачный раствор мутнеет от выделения нерастворимого в воде карбоната кальция СаСО3:
Са(ОН)2 + СO2 = СаСО3↓ + Н2O
в ионной форме:
Са2+ + 2OН- + СO2 = СаСO3↓ + Н2O
Когда фенолфталеин обесцветится, реакция закончилась. Вся щелочь израсходовалась, ионов ОН- в растворе не осталось.
Продолжим опыт. Будем и далее пропускать углекислый газ. Муть исчезает. Следовательно, карбонат кальция превратился в другое соединение, растворимое в воде. Каков его состав?
Углекислый газ, соединяясь с водой, образует угольную кислоту:
СO2 + Н2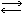 Н2СO3
Н2СO3
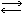 Н2СO3
Н2СO3Эта кислота реагирует с карбонатом кальция:
СаСО3 + Н2СО3 = Са2+ + 2НСO3-
Образуется растворимый в воде бикарбонат кальция, раствор становится прозрачным. Ионное уравнение реакции:
СаСО3 + СO2 + Н2O = Ca2+ + 2HCO3
Нагреем полученный раствор бикарбоната кальция. Он опять становится мутным, так как происходит обратная реакция, при которой образуется карбонат кальция:
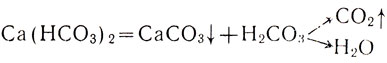
или в ионной форме ...?
Эти реакции играют большую роль в природе. Дождевая вода растворяет углекислый газ и, просачиваясь через почву, взаимодействует с известняком, растворяя его в виде бикарбоната. Особенно энергично эта реакция протекает в толщах известняковых пород. При выходе такой воды на поверхность и испарении ее вновь выпадает карбонат кальция.
Эти реакции приводят к образованию пещер и возникновению в них причудливых сталактитов (рис. 54).

Рис. 54. Сталактиты
Гипс. Из солей кальция, кроме карбоната, представляет большой интерес гипс CaSO4*2H2O. При не слишком сильном нагревании гипс выделяет 3А кристаллизационной воды и превращается в белый порошок полуводного гипса (CaSO4)2*H2O.
2CaSO4*2Н20 = (CaSO4)2*H2O + 3H2O
При смешивании такого порошка с водой происходит обратная реакция
Ca(SO4)2*H2O + 3H2O = 2CaSO4*2H2O
Смесь полуводного гипса с водой (густоты сметаны) вследствие этого затвердевает. Это используют на практике: из гипса делают лепные украшения, статуэтки. В смеси с гашеной известью полуводный гипс применяют для штукатурки стен; в хирургии его применяют для накладывания гипсовых повязок, которые удерживают кости в правильном положении, пока они не срастутся.
Гипс немного растворим в воде. С повышением температуры свыше 60°С растворимость гипса не возрастает, а уменьшается. Поэтому в чайниках возможно осаждение гипса в виде накипи.
- Сравните свойства кальция (в свободном состоянии) со свойствами А щелочных металлов. Приведите уравнения соответствующих реакций в молекулярной и сокращенной ионной форме. Почему кальций - легкий и прочный металл - не применяется для производства самолетов?
- Опишите свойства окиси кальция. Почему строители называют ее "кипелкой"? Как она получается в промышленности?
- Опишите свойства гидроокиси кальция. Почему строители называют ее "пушонкой"?
- Опишите свойства и применение гипса.
- Вы получили известковую воду и желаете ее сохранить до следующего урока химии. Как это сделать?
- * Известковую воду разделили на две одинаковые порции. Через одну пропускали углекислый газ, пока выпавший осадок не растворился, затем обе порции вновь слили. Что должны наблюдать при этом? Будет ли полученная взвесь обладать электропроводностью? Напишите уравнения реакций в молекулярной и ионной формах.
- Какое превращение испытывает гашеная известь в домах-новостройках и почему пока это превращение не закончится, здание остается сырым?
- Напишите уравнения реакций, при помощи которых можно осуществить следующие переходы:
СаСl2→Са→СаО→Са(ОН)2→СаСО3→Са(НСО3)2→СаСО3→СаСl2
- * Даны химические элементы А, Б и В. Соединение А с В растворяется в воде, и в полученном растворе лакмус окрашивается в синий цвет. Соединение всех трех элементов нерастворимо в воде, но растворяется в ней, если одновременно с водой на него действуют соединение Б с В. Что представляют собой элементы А, Б, В и упомянутые в условиях задачи их соединения? Напишите уравнения реакций, о которых идет речь.
- * Как будет изменяться свечение лампочки в приборе для испытания электропроводности, если в нем пропускать двуокись углерода через известковую воду?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'