
§ 68. Жесткость воды и способы ее устранения
Вода, прежде чем попасть в колодец или водопроводную сеть, просачивается сквозь почву и насыщается в ней растворимыми солями.
Природные воды содержат сульфаты и бикарбонаты кальция и магния, т.е. катионы Са2+ и Мg2+, анионы SO42- и НСО3-. Вода, в которой содержание ионов Са2+ и Mg2+ незначительно, называется мягкой, вода с повышенным содержанием их - жесткой.
При кипячении жесткой воды бикарбонаты разлагаются, образуя нерастворимые карбонаты, например:
Са2+ + 2НСO3- = СаСО3↓ + Н2O + СO2↑
Карбонаты осаждаются, и жесткость воды уменьшается. Жесткость, вызываемая содержанием в воде бикарбонатов кальция и магния, называется карбонатной или временной. Жесткость, обусловленная присутствием прочих солей кальция и магния и сохраняющаяся после кипячения воды, называется некарбонатной или постоянной.
Широко известно, что в жесткой воде мыло плохо мылится. Изучим это явление на опыте, взяв в качестве искусственной жесткой воды, например, раствор гипса. Нальем в бюретку разбавленный раствор мыла и будем приливать его понемногу, порция за порцией, к жесткой воде, сильно встряхивая после каждого приливания стакан с жесткой водой. Первые порции мыла будут затрачиваться на образование хлопьевидного осадка, и пены при встряхивании получаться не будет. Только после того, как прекратится образование осадка, появится пена.
Мыла - это натриевые (иногда калиевые) соли органических кислот, и их состав можно условно выразить формулой NaR или KR, где R - кислотный остаток. Анионы R- образуют с катионами кальция и магния нерастворимые соли CaR2 и MgR2. На образование этих нерастворимых солей и расходуется бесполезно мыло. Таким образом, при помощи мыльного раствора мы можем оценить общую жесткость воды, общее содержание в ней ионов кальция и магния.
Для хозяйственно-бытовых нужд требуется вода С незначительной жесткостью. При кипячении жесткой воды образуется накипь. В жесткой воде плохо развариваются мясо, овощи, крупа. При стирке тканей жесткой водой образующиеся нерастворимые соединения осаждаются на поверхности нитей и постепенно разрушают волокна.
При питании паровых котлов жесткой водой образуется накипь. Накипь затрудняет нагревание воды, вызывает увеличение расхода топлива, ускоряет изнашивание стенок котла (рис. 57).

Рис. 57. Разрез трубы водяного отопления. Просвет почти забит накипью
Для понижения жесткости воды применяют различные методы. Перед направлением в паровой котел воду предварительно нагревают, чем устраняют временную жесткость. Для питания котлов высокого давления в настоящее время часто применяют перегнанную (дистиллированную) воду. Для понижения жесткости воды используют химические методы, приводящие к переводу ионов кальция и магния в состав нерастворимых солей, обычно в карбонаты.
Карбонатную жесткость устраняют добавлением известкового молока:
Са(НСО3)2 + Са(ОН)2 = 2СаСO3↓ + 2Н2O
Некарбонатная жесткость устраняется добавкой соды:
CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4
Природную воду, содержащую ионы кальция Са2+ и магния Mg2+, можно смягчить, освободить от этих ионов, заменив их, например, ионами натрия, при помощи ионообмена. Для этого воду на станциях водоочистки пропускают через ионнообменную колонку с катионитом, содержащим подвижные ионы Na+. Ионы кальция и магния удержатся в катионите, а в воду перейдет из катионита эквивалентное количество безвредных ионов натрия:
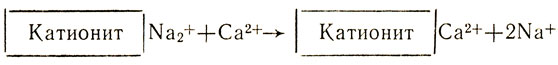

- Какая вода более жесткая: дождевая или речная? Почему?
- Объясните, почему в речной воде содержатся бикарбонаты кальция и магния.
- Как частично смягчить воду, не применяя химических реактивов?
- Напишите в ионной форме уравнения реакций, применяющихся при устранении: а) карбонатной жесткости, б) некарбонатной жесткости.
- Почему постоянную жесткость, обусловленную содержанием в воде гипса, нельзя устранить добавкой гидроокиси кальция?
- Испытайте разными способами на жесткость пробы воды, взятые из разных окрестных источников.
- * Чистую воду получают иногда не путем перегонки природной воды, а пропуская ее последовательно через две колонки, содержащие: одна - катионит, "заряженный" ионами водорода, а другая - анионит, "заряженный" ионами гидроксила. Объясните, каким образом при такой обработке вода освобождается от любых катионов и анионов и становится химически чистой.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'