
§ 69. Главная подгруппа II группы
В главной подгруппе II группы элементов кальцию предшествуют бериллий и магний, а за ним следуют стронций, барий и радий. Скачки в величине радиусов атомов у металлов с большими порядковыми номерами, начиная с кальция, относительно невелики (табл. 12). Поэтому эти металлы особенно близки по химическим свойствам и объединяются с кальцием под названием щелочноземельные металлы. Щелочноземельные металлы наиболее ярко проявляют металлические свойства, следовательно, наиболее сходны с щелочными металлами.
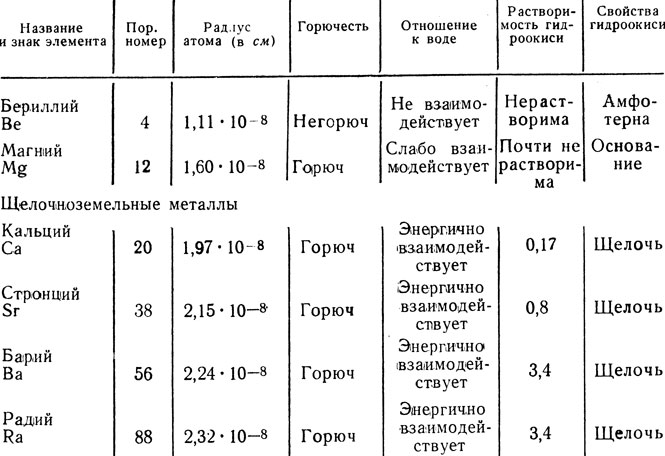
Таблица 12
Как видно из таблицы 12, свойства элементов главной подгруппы II группы с возрастанием порядкового номера изменяются так же, как у щелочных металлов: растет их химическая активность по отношению к воде, возрастает растворимость гидроокисей в воде, т. е. усиливаются основные свойства. Сравним, например, магний с кальцием как представителем щелочноземельных металлов.
В отличие от кальция, магний настолько медленно взаимодействует с водой при обычных температурах, что применяется в виде сплавов как конструкционный материал в самолетостроении.
"логическая активность магния, в отличие от кальция, проявляется лишь при высоких температурах. Будучи подожжен магний горит не только на воздухе, но и в водяных парах, восстанавливая водород и образуя окись магния:
Mg + H2О = MgO + H2↑
Зажжем на металлической сетке стружки магния (рис. 58). Магний горит, излучая ослепительно яркий свет. Погрузим сетку с горящим магнием в воду: горение не только не прекращается, но усиливается, при этом над горящим в водяных парах магнием вспыхивает бледное пламя горящего водорода. Вода становится мутной от накопления в ней частичек окиси магния. Прильем к воде раствор фенолфталеина. Долгое время он остается бесцветным, затем все же окрасится в малиновый цвет. Подобно окиси кальция, но медленнее, окись магния соединяется с водой, образуя гидроокись.
MgO + H2O = Mg(OH)2

Рис. 58. Горение магния в водяных парах
При этом раствор остается мутным. Значит, и гидроокись магния, как и его окись, лишь незначительно растворима в воде. Все же в растворе накопляется достаточно ионов гидроксила, чтобы фенолфталеин окрасился:
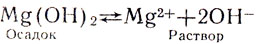

- Какие металлы называются щелочноземельными? Почему не существует изделий из них?
- Какие закономерности проявляются в изменении химических свойств металлов главной подгруппы II группы с возрастанием порядкового номера?
- У какого из металлов данной подгруппы металлические свойства выражены наиболее сильно? Наиболее слабо? В чем это проявляется?
- Напишите уравнение реакции раствора нитрата магния с известковой водой (в ионной форме).

На следующем уроке вы приступите к изучению алюминия, поэтому:
- Возьмите фольгу, в которую завертывают конфеты, или крышку от молочных бутылок (они сделаны из алюминия). Опишите физические свойства алюминия.
- Исследуйте, горит ли алюминий на воздухе и как легко плавится. Для этого отрежьте полоску фольги, закрепите один конец, а к другому концу поднесите зажженную спичку. Опишите, что произойдет. (Вопрос: "Что мешает алюминию после того, как он расплавится, стечь с нагретой полоски в виде капель?" - разрешится на уроке.)
- Поместите по кусочку фольги в воду, в нашатырный спирт, в столовый уксус. Опишите, что произойдет через несколько суток. Опыт закончите, когда в одном из растворов кусочек фольги обратится в тончайшее металлическое "кружево". Сохраните его.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'