
§ 70. Алюминий
Химический знак - Al. Порядковый номер - 13.
Атомный вес - 27. Строение атома: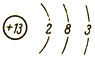
Алюминий - металл серебристо-белого цвета. Он относится к легким металлам - плотность алюминия 2,7. Температура плавления довольно низкая (659°С): алюминиевая фольга легко плавится в пламени спички.
Алюминий - хороший проводник теплоты и электрического тока: его электропроводность составляет около 2/3 от электропроводности меди. Пластичность алюминия очень высока. Его можно вытягивать в проволоку и прокатывать в фольгу.
При химических реакциях атом алюминия отдает три электрона внешнего слоя, обращаясь в трехзарядный положительный ион Аl3+. Поэтому во всех своих устойчивых соединениях алюминий положительно трехвалентен.
В ряду напряжений алюминий близок к щелочным и щелочноземельным металлам (см. стр. 126) и должен проявлять себя как химически активный металл. Не противоречит ли этому повседневный опыт? Ведь в алюминиевых чайниках и кастрюлях изо дня в день кипятят воду и варят пищу без видимых изменений посуды. Создается впечатление, что ни кислород, ни вода, даже при температуре ее кипения, на алюминий не действуют.
Установить причину этого противоречия поможет опыт. Закрепим алюминиевую проволоку в наклонном положении в штативе и будем нагревать нижний конец ее в пламени горелки (рис. 59). Нагретый конец проволоки внезапно провисает. Вглядевшись, можно увидеть, что алюминиевая проволока облеклась в полупрозрачную оболочку - чехольчик, внутри которого расплавленный алюминий, блестя, подобно серебру, стекает вниз, раздувая нижний конец чехольчика. Чехольчик состоит из окиси алюминия. Таким образом, при нагревании на воздухе алюминий окисляется с поверхности, не загораясь, и образуется окись алюминия Аl2O3:
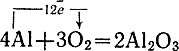

Рис. 59. Провисание алюминиевой проволоки при плавлении
Алюминий соединяется с кислородом воздуха и при обыкновенной температуре. На его поверхности тотчас образуется тончайшая плотная пленка окиси алюминия. Она трудно проницаема для газов и предохраняет металл от дальнейшего окисления.
При повреждении поверхности алюминия с нее, конечно, снимается и защитная пленка, но взамен тотчас образуется на поврежденной поверхности новый слой окисла. Растворяя алюминий в реактивах, не действующих на его окисел, окисную пленку удалось изолировать в виде тончайших прозрачных лоскутков.
Существование защитной пленки доказывается и так. Если погрузить кусочек алюминия в ртуть и под ртутью (чтобы исключить соприкосновение алюминия с воздухом) процарапать алюминий в нескольких местах напильником, то в царапинах образуется амальгама алюминия - сплав его с ртутью. На амальгамированной поверхности алюминия окисная пленка не удерживается и отслаивается. Защитное действие прекращается, и алюминий, вынутый из ртути, в процарапанных местах быстро окисляется, образуя белую пушистую, окись алюминия (рис. 60).
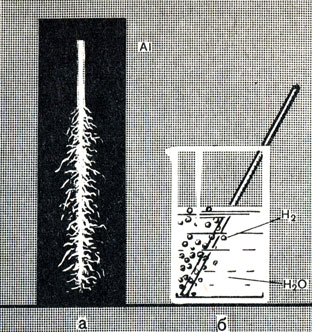
Рис. 60. Окисление амальгамированного алюминия. а - на воздухе, б - в воде
Теперь легко объяснить пассивность алюминия по отношению к воде. Отсутствие реакции между алюминием и водой объясняется тем, что пленка окиси алюминия, покрывающая его поверхность, не растворяется в воде.
Если эту пленку удалить путем процарапывания алюминия под ртутью и погрузить после этого алюминий в воду, то он будет энергично взаимодействовать с водой, вытесняя из нее водород:
2Аl + 6Н2O = 2Аl(ОН)3↓ + 3Н2↑
Окись и гидроокись алюминия обладают основными свойствами и в кислотах растворяются, открывая доступ кислоте к металлическому алюминию.
Опустим алюминиевые стружки в пробирку с соляной кислотой или разбавленной серной кислотой. Алюминий растворяется, вытесняя из кислоты водород и образуя соль, например:
2Аl + 6НСl = 2АlСl3 + 3Н2↑
С концентрированной азотной кислотой, в отличие от разбавленной, алюминий при обыкновенной температуре не реагирует. Поэтому концентрированную азотную кислоту хранят в алюминиевых сосудах и перевозят в алюминиевых цистернах.
Алюминий взаимодействует при нагревании с окислами большинства металлов, в том числе с железной окалиной. При этом образуются железо и окись алюминия:
8Al + 3Fe3O4 = 9Fe + 4Al2O3 + 774 ккал
Свернем из асбеста стаканчик, обвязав его проволокой, поставим на кусок железного листа, а лист на таганок, под который подставим миску с песком (рис. 61). Насыплем в асбестовый стаканчик смесь порошка алюминия и железной окалины, воткнем в эту смесь магниевую ленточку, зажжем ее. От загоревшегося магния загорится смесь алюминия с железной окалиной, разбрасывая искры - раскаленные и горящие на воздухе капли восстановленного железа. При реакции развивается такая высокая температура (до 3000°С), что оба продукта реакции, т. е. не только железо, но и окись алюминия, плавятся. Когда горение смеси достигает железной подставки, железный лист мгновенно проплавляется и расплавленная масса раскаленной струей выливается в песок. После ее затвердевания ударами молотка можно освободить слиток выплавленного железа.

Рис. 61. Восстановление алюминием железа из его окалины
Итак, алюминий относится к числу химически активных металлов, занимая среди них место тотчас за щелочными и щелочноземельными металлами.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'