
§ 75. Побочная подгруппа VI группы
В побочную подгруппу VI группы, кроме хрома, входят два особенно сходных друг с другом металла: молибден Мо и вольфрам W, первый относится к V, второй - VI периоду.
В V периоде элемент IV группы - цирконий - непосредственно следует за элементом III группы - иттрием, а в VI периоде между элементом III группы - лантаном - и элементом IV группы - гафнием - вклинивается длинный ряд лантанидов. У лантанидов происходит достройка электронами третьего снаружи электронного слоя. С возрастанием заряда атомного ядра у них электронные оболочки все более стягиваются к ядру, и радиус атома уменьшается (табл. 13). Из-за этого и у элементов, следующих за лантанидами, атомные радиусы оказываются относительно малыми и близкими к атомным радиусам соответствующих элементов V периода. Сходство строения атомов здесь дополняется близостью их радиусов. Поэтому и по химическим свойствам элементы цирконий и гафний, ниобий и тантал, молибден и вольфрам и т. д. оказываются попарно чрезвычайно сходными.
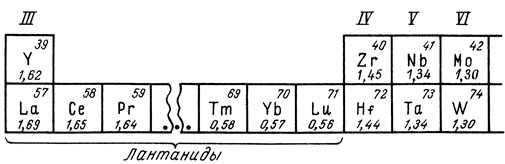
Таблица 13
Подобно хрому, молибден и вольфрам проявляют переменную валентность, но, в отличие от хрома, устойчивыми у них являются соединения, отвечающие их высшей валентности +6. Их окислы МоO3 и WO3 вследствие высокой валентности металла являются ангидридами. Им отвечают в качестве гидратов кислоты: Н2МoО4 - молибденовая и H2WO4 - вольфрамовая.
С возрастанием порядкового номера элемента в подгруппе хрома точка плавления металлов возрастает. Вольфрам - самый тугоплавкий из металлов. Он используется для изготовления нитей накала электролампочек. Ничтожная испаряемость вольфрама при высоких температурах обеспечивает долговечность нити накала. Но если извлечь такую нить из перегоревшей лампочки и внести в пламя, вольфрам окисляется в вольфрамовый ангидрид. Вольфрамовый и молибденовый ангидриды летучи при высоких температурах, в отличие от окиси хрома Сr2O3, и не могут защитить металл на воздухе от окисления. Поэтому лампочки и приходится наполнять разреженным инертным газом.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'