
§ 76. Железо
Химический знак - Fe. Порядковый номер - 26

При химических реакциях от атома железа, кроме 2 электронов внешнего слоя, могут отрываться электроны предпоследнего слоя. В соединениях оно обычно проявляет валентности 2+ и 3+.
О физических свойствах железа можно судить по железным гвоздям. Это металл серебристо-белого цвета. Железо очень пластично, оно легко куется и вытягивается в проволоку. Среди других металлов железо выделяется магнитными свойствами: оно притягивается магнитами и само намагничивается, если кусок железа обмотать проволокой и пропустить по ней электрический ток.
Если железную проволоку нагревать, пропуская через нее электрический ток нарастающей силы, то сначала проволока все более провисает, так как от нагревания железо расширяется. Но как только температура достигает 910°С, проволока внезапно натягивается, т. е. железо сжимается. При этой температуре расположение атомов в кристаллической решетке железа меняется, решетка уплотняется и обыкновенное железо, или α-железо, превращается в другую аллотропную модификацию - γ-железо. Оно, в отличие от α-железа, немагнитно и способно науглероживаться, т. е. впитывать атомы углерода. Получается твердый раствор углерода в железе, в котором атомы углерода размещаются в кристаллах железа в промежутках между атомами железа. В состоянии твердого раствора γ-железо может удержать не более 2% углерода.
При температуре более 1500°С железо плавится, превращаясь в подвижную, легко расплескивающуюся жидкость. Жидкое железо еще более жадно поглощает углерод, чем твердое γ-железо.
Расплавленное железо растворяет до 4% углерода. При затвердевании сплавов железа с углеродом растворенный углерод может выделиться в виде графита или в виде соединения с железом - карбида железа Fe3C - или же остаться в виде твердого раствора.
Железо образует два ряда соединений:
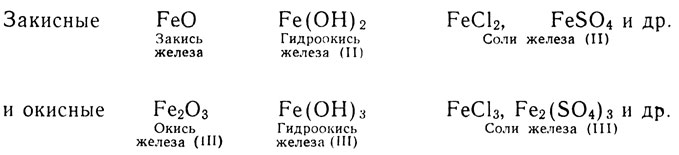
Кроме закиси и окиси, железо образует с кислородом соединение промежуточного состава - закись-окись, в котором оно содержится частью в двух-, частью в трехвалентном состоянии:
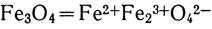
В кислороде железо сгорает, разбрасывая искры - раскаленные капельки железной окалины Fe3O4, а при накаливании на воздухе окисляется с поверхности, образуя окалину в виде корки, отслаивающейся под ударами молота при ковке. Искры, вырывающиеся при точке стального инструмента, выбрасывающиеся при разливке чугуна, представляют собой раскаленные частички той же окалины. Во всех этих случаях происходит одна и та же реакция:
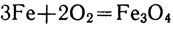
Рассмотрим отношение железа к воде и кислороду при обычных температурах. Поместим три железных гвоздя: один - в закупоренную пробирку с сухим кислородом, другой - в пробирку с водой, предварительно прокипяченной для удаления растворенного в ней кислорода, а третий - в пробирку с кислородом, опрокинутую в сосуд с водой. В двух первых пробирках с железом не произойдет никаких изменений, а в третьей железо заржавеет, и уровень воды в ней поднимется. Это означает, что кислород расходуется на ржавление железа. Получается желто-бурая ржавчина, состоящая главным образом из гидроокиси железа (III):
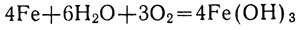
Ржавеет не только погруженная в воду часть гвоздя. Отдельные пятнышки ржавчины появляются и на выступающем над водой сухом конце его.
Из этих опытов следует, что при обычных температурах ни сухой кислород, ни вода в отсутствии кислорода на железо не действуют. Во влажном воздухе и в воде, содержащей растворенный кислород, железо ржавеет, покрываясь рыхлой, легко отслаивающейся коркой ржавчины. Эта корка проницаема для газов и паров, а поэтому не защищает металл от дальнейшего их действия. Наоборот, достаточно появиться на железном изделии пятнышку ржавчины, как она, притягивая влагу из воздуха, лишь ускоряет дальнейшее ржавление. Ржавление железных предметов, раз начавшись в одном месте, постепенно распространяется дальше.
В электрохимическом ряду напряжений железо расположено перед водородом. Поэтому оно растворяется в разбавленной серной и соляной кислотах, вытесняя из них водород и образуя соответствующую закисную соль, например:
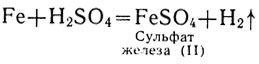
или в сокращенном ионном виде:
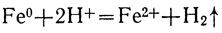
Но концентрированная серная и азотная кислоты на железо при обыкновенной температуре не действуют, благодаря образованию на поверхности металла плотных пленок из нерастворимых в этих кислотах соединений железа.
Железо вытесняет из водных растворов солей медь и другие металлы, расположенные правее в электрохимическом ряду напряжений, например:
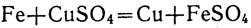
При этом, как и при растворении в кислотах, железо переходит в свою закисную соль, т. е. образуются ионы Fe2+.
Соединения железа. Соли закисного железа в растворе имеют слабо зеленоватую окраску, свойственную гидратированным ионам Fe2+. При приливании к раствору соли двухвалентного железа, например хлорида железа (II), раствора щелочи выпадает белый хлопьевидный осадок гидроокиси железа (II):
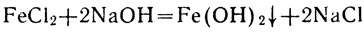
или в ионной форме ...?
На воздухе осадок тотчас зеленеет, а затем буреет вследствие окисления гидроокиси железа (II) в гидроокись железа (III):
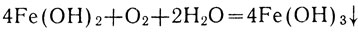
Гидроокись железа (II) в избытке щелочи не растворяется. Но она легко растворяется в кислотах, превращаясь в соли закисного железа:
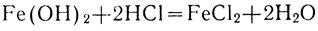
или в ионной форме ...?
Гидроокись железа (II) является, таки0м образом, основанием.
Растворы солей трехвалентного железа, например хлорида железа (III), имеют желтую окраску. При приливании к раствору такой соли раствора щелочи выпадает желто-бурый осадок гидроокиси железа (III):
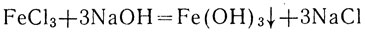
или в ионной форме ... ?
Гидроокись железа (III) растворяется в кислотах, образуя соли окисного железа:
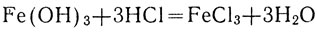
или в ионном виде ...?
Гидроокись железа (III) является, таким образом, основанием, как и гидроокись железа (II). Но гидроокись железа (III) более слабое основание, чем гидроокись железа (II). Это проявляется в неодинаковой степени гидролиза солей железа (II) и солей железа (III). Соли железа (II) гидролизуются в растворе слабо, а соли - железа (III) настолько сильно, что гидролиз доходит до образования коллоидных частиц гидроокиси железа (III), вспомним, как мы получали ее коллоидный раствор. Желтая окраска растворов солей трехвалентного железа и принадлежит не ионам трехвалентного железа, а коллоидным частицам гидроокиси железа (III). В концентрированных растворах щелочей Fe(ОН)3 растворяется подобно Аl(ОН)3 и Сr(ОН)3, образуя ферриты MeH2FeО3 (подобно МеН2АlO3 и МеН2СrO3).
Таким образом, возрастание валентности железа с 2+ до 3+ привело к упрочению связи его ионов с ионами гидроксила.
Наиболее широко применяемая из солей железа - железный купорос FeSO4*7H2O. Его используют в производстве красок, для пропитки древесины, чтобы предотвратить ее гниение.
Железо образует также сложные, или комплексные, соединения, в которых оно содержится в составе аниона: желтую кровяную соль K4Fe2+(CN)6-] и красную кровяную соль K3[Fe3+(CN)6-]. Состав аниона обеих солей одинаков, но валентность железа в них разная: в желтой соли оно двухвалентно, а в красной - трехвалентно. Хотя обе соли содержат в себе железо, они служат реактивами на свободные ионы железа. Для открытия ионов двухвалентного железа реактивом служит та из этих солей, в которой железо трехвалентно, т. е. красная соль, а для открытия ионов трехвалентного железа - та, в которой железо двухвалентно, т. е. желтая. При приливании к раствору, содержащему ионы двух- или трехвалентного железа, раствора соответствующей кровяной соли получается чрезвычайно интенсивно окрашенный синий осадок, в обоих случаях одинакового состава, содержащий ионы и двух- и трехвалентного железа. (Убедитесь в этом, составив уравнения реакций в ионной форме и раскрыв в формулах продуктов обеих реакций - как в алгебраических формулах - квадратные скобки.)
Железо - второй по распространенности в природе металл, после алюминия. Промышленное значение в качестве железных руд имеют главным образом красный железняк Fe2O3 и магнитный железняк Fe3O4. По запасу железных руд наша страна занимает первое место в мире. Они залегают на Урале, в Курской области, в Криворожье и в других местах. Железо входит в состав растительных и животных организмов. Оно содержится в гемоглобине крови, переносящем кислород из легких в ткани, и необходимо для образования в растениях хлорофилла, хотя в состав его не входит. При недостатке железа в почве растения перестают образовывать хлорофилл и утрачивают зеленую окраску.

- Опишите: а) физические, б) химические свойства железа.
- Напишите уравнения реакций железа с растворами: а) бромистоводородной кислоты, б) нитрата серебра.
- При побелке потолков и стен используют раствор медного купороса. Можно ли готовить и хранить его в железных ведрах?
- Как отличить соль двухвалентного железа от соли трехвалентного железа, если обе соли растворимы в воде?
- Опишите свойства гидроокисей железа.
- Напишите уравнения реакций, при помощи которых можно было бы осуществить следующие превращения:
Fe2O3→Fe→FeCl2→Fe(ОН)2→Fe(ОН)3→Fe2O3.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'