
Лабораторные опыты
1. Реакции обмена между растворами электролитов
Опыт 1. К 2-3 мл раствора хлорида железа (III) прилейте такой же объем раствора едкого натра. Что наблюдаете? Напишите полное и сокращенное ионные уравнения реакций.
Опыт 2. К 1-2 мл раствора сульфита натрия прилейте такой же объем раствора серной кислоты и слегка нагрейте. Осторожно понюхайте выделяющийся газ (какой это газ?) и подержите над отверстием пробирки влажную синюю лакмусовую бумажку. Как изменился цвет бумажки? Почему? Напишите полное и сокращенное ионные уравнения реакций.
Опыт 3. В пробирку с 2-3 мл раствора едкого натра прибавьте 2-3 капли раствора фенолфталеина. Какая появилась окраска и почему? Затем приливайте небольшими порциями, перемешивая, раствор серной кислоты до обесцвечивания. Почему раствор обесцветился? Напишите полное и сокращенное ионные уравнения реакций.
Опыт 4. Пользуясь имеющимися на столе реактивами, получите: а) гидроокись меди (II), б) сульфат бария. Напишите полные и сокращенные ионные уравнения проделанных реакций.
2. Испытание растворов солей индикатором
В три пробирки налейте по 1 мл растворов: нитрата свинца, карбоната натрия и хлорида натрия. Промойте стеклянную палочку в стакане с дистиллированной водой и с помощью ее перенесите каплю каждого раствора на синюю и красную лакмусовые бумажки. Отметьте, в какой цвет окрашивается лакмусовая бумажка от действия на нее каждым из указанных растворов.
3. Получение аммиака и опыты с ним
Опыт 1. Соберите прибор, как показано на рисунке 72. В ступке перемешайте равные по объему количества хлорида аммония и гидроокиси кальция (объем смеси должен быть около 1/3 пробирки). Осторожно понюхайте смесь. Запах какого вещества вы ощущаете?
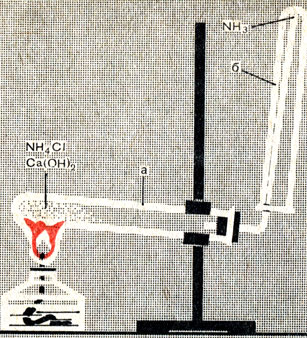
Рис. 72. Прибор для получения и собирания аммиака
Пересыпьте приготовленную смесь в пробирку, закройте ее пробкой с газоотводной трубкой и укрепите в лапке штатива так, чтобы дно пробирки было немного выше отверстия. (В каких случаях так укрепляется пробирка?) На газоотводную трубку прибора наденьте сухую пробирку. Почему пробирка для собирания аммиака перевернута вверх дном?
Пробирку со смесью прогрейте сначала всю, а потом нагревайте ее в том месте, где лежит смесь хлорида аммония и гидроокиси кальция. Обратите внимание на появление капель воды на стенках пробирки около пробки.
Когда пробирка, надетая на газоотводную трубку, наполнится газом (об этом вы узнаете по появлению запаха у отверстия пробирки), медленно снимите ее, сейчас же закройте отверстие большим пальцем и опустите в сосуд с водой. Отнимите палец под водой. Что наблюдаете? Почему вода поднялась в пробирке? (Поднятие воды можно ускорить покачиванием пробирки.) Снова закройте пальцем отверстие под водой и выньте пробирку из воды.
Опыт 2. К полученному раствору аммиака прилейте каплю раствора фенолфталеина или испытайте раствор лакмусовой бумажкой. Появлением каких ионов в растворе можно объяснить изменение окраски индикатора?
Опыт 3. Снова нагрейте смесь хлорида аммония и гидроокиси кальция в том же приборе и поднесите к отверстию газоотводной трубки лучинку, смоченную концентрированной соляной кислотой. Что наблюдаете? Сделайте то же самое, смочив другую лучинку концентрированной азотной кислотой. Напишите уравнения реакций.
4. Ознакомление со свойствами гидроокиси аммония
Опыт 1. В пробирку налейте 4-5 мл раствора аммиака в воде и добавьте в него 2-3 капли раствора фенолфталеина. Каков цвет раствора? Нагрейте этот раствор до кипения. Как изменился цвет раствора? Почему? Напишите уравнение реакции.
Опыт 2. Налейте в пробирку 4-5 мл раствора аммиака в воде. Добавьте в него 2-3 капли раствора фенолфталеина и приливайте к нему по каплям раствор серной кислоты до исчезновения малиновой окраски. Почему исчезла окраска? Напишите ионные уравнения реакций (полное и сокращенное).
Опыт 3. В пробирку налейте 2-3 мл раствора хлорида алюминия и добавьте столько же раствора гидроокиси аммония. Что наблюдаете? Напишите ионные уравнения реакций (полное и сокращенное).
5. Взаимодействие солей аммония со щелочами
Налейте в пробирку 2-3 мл раствора сульфата аммония и добавьте столько же раствора едкого натра. Нагрейте жидкость в пробирке до кипения и осторожно понюхайте выделяющийся газ. Поднесите к отверстию пробирки красную лакмусовую бумажку, смоченную водой. Как изменилась окраска лакмусовой бумажки? Почему? Напишите уравнение реакции.
6. Ознакомление со свойствами ортофосфорной кислоты, фосфатов и гидрофосфатов
Опыт 1. Налейте в стакан 10-15 мл известковой воды и прибавляйте по каплям раствор ортофосфорной кислоты (1:20), все время перемешивая. Появляется помутнение вследствие образования нерастворимого в воде фосфата кальция:
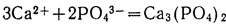
Продолжайте приливать раствор фосфорной кислоты и перемешивать. Помутнение исчезает вследствие образования растворимого в воде дигидрофосфата кальция:
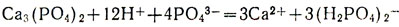
Опыт 2. В три пробирки насыпьте по 1/4 чайной ложки: фосфата кальция, гидрофосфата кальция и дигидрофосфата кальция. Во все пробирки прилейте по 5 мл воды и перемешайте. Что наблюдаете? Объясните наблюдаемые явления.
7. Ознакомление с азотными и фосфорными удобрениями
Опыт 1. Рассмотрите выданные вам образцы минеральных удобрений. Обратите внимание на различный цвет их, кристаллическое строение большинства удобрений, кроме фосфоритной муки, имеющей пылевидную структуру.
Насыпьте в пробирки по 1/4 чайной ложки каждого удобрения, прилейте в каждую пробирку по 5 мл дистиллированной воды и перемешайте. Одинакова ли растворимость выданных вам удобрений? Результаты наблюдений запишите в таблицу:
Опыт 2. Проделайте реакции, подтверждающие качественный состав аммиачной селитры. Насыпьте в пробирку 1/4 чайной ложки аммиачной селитры и столько же медных опилок. Прилейте несколько капель концентрированной серной кислоты. Что наблюдаете? Наличие каких ионов в аммиачной селитре подтверждает проведенная реакция? Напишите уравнения реакций.
В другую пробирку налейте 2-3 мл приготовленного вами раствора аммиачной селитры и проведите испытания, описанные в работе 5 (стр. 192).
Опыт 3. Слейте в пробирку полученный вами в опыте раствор суперфосфата и прилейте 5-6 капель раствора нитрата серебра. Что наблюдаете? Напишите ионные уравнения реакций (полное и сокращенное).
8. Ознакомление со свойствами карбонатов и бикарбонатов
Опыт 1. В три пробирки насыпьте понемногу (чтобы только покрылось дно пробирки) карбоната натрия, карбоната магния и бикарбоната натрия. Во все пробирки прилейте по 1 мл разбавленной соляной кислоты. Что наблюдаете? В каждую пробирку внесите зажженную лучинку. Что наблюдаете? Напишите ионные уравнения реакций между карбонатами и соляной кислотой (полные и сокращенные).
Опыт 2. Соберите прибор, как показано на рисунке 73. Всыпьте в пробирку (около 0,1 ее объема) бикарбоната натрия, закройте пробирку пробкой с газоотводной трубкой и укрепите в лапке штатива так, чтобы наклон был в сторону пробки. (В каких случаях так укрепляют прибор?) Опустите конец газоотводной трубки до дна пробирки, заполненной на 1/4 известковой водой. Нагрейте слегка всю пробирку с бикарбонатом натрия, после чего нагрейте сильнее ее в том месте, где лежит бикарбонат натрия. Наблюдайте за изменениями, происходящими в пробирке с бикарбонатом, натрия и в пробирке с известковой водой.
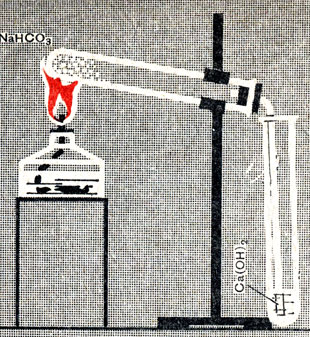
Рис. 73. Прибор для разложения бикарбоната натрия
После помутнения известковой воды поднимите штатив с прибором и оставьте его; горелку погасите.
Какие вещества образовались при прокаливании бикарбоната натрия? Какая реакция происходила при пропускании двуокиси углерода в известковую воду? Напишите уравнения реакций.
9. Качественная реакция на карбонат-ион
Опыт 1. В пробирку налейте 1 мл раствора карбоната натрия и прилейте столько же раствора хлорида бария. Что наблюдаете? Напишите ионные уравнения реакций (полное и сокращенное).
К образовавшемуся осадку прибавьте около 1 мл разбавленной соляной кислоты. Что наблюдаете? Какой газ выделяется? Напишите ионные уравнения реакций (полное и сокращенное).
Опыт 2. В пробирку налейте 1 мл раствора карбоната натрия и добавьте несколько капель раствора нитрата серебра. Что наблюдаете? Напишите ионные уравнения реакций (полное и сокращенное).
К образовавшемуся осадку прилейте 0,5 мл разбавленной азотной кислоты. Что наблюдаете? Какой газ выделяется? Напишите ионные уравнения реакций (полное и сокращенное).
Опыт 3. Вам выданы три пробирки с растворами: хлорида, карбоната и сульфата. Определите опытным путем, в какой пробирке находится карбонат. Напишите сокращенное ионное уравнение проведенной вами реакции. Какое вещество можно использовать в качестве реактива на карбонат-ион?
10. Испытание растворов карбонатов и силикатов индикатором
Опыт 1. В одну пробирку налейте 1 мл раствора карбоната натрия, в другую - 1 мл силиката натрия.
Промойте стеклянную палочку в стакане с дистиллированной водой и с ее помощью перенесите каплю каждого раствора на красные лакмусовые бумажки. Отметьте, в какой цвет окрашивается лакмусовая бумажка от действия каждым из указанных растворов. Что можно сказать на основании проведенного вами исследования о силе угольной и кремниевой кислот? Напишите уравнения реакций гидролиза указанных в опыте солей.
11. Изучение строения пламени
Опыт 1. Зажгите парафиновую (или восковую) свечу, накапайте парафина на кусочек картона (или фанеры) и укрепите на нем зажженную свечу. Когда свеча разгорится, рассмотрите пламя и зарисуйте его строение, отметив три части: темную, яркую и малозаметную.
Опыт 2. Внесите в пламя тонкую лучинку, держа ее горизонтально над самым фитилем (рис. 39). Как только лучинка начнет темнеть, быстро выньте ее, не давая загореться. В каких местах обуглилась лучинка? Какая часть пламени наиболее горячая?
Опыт 3. Что находится во внутренней (темной) части пламени? Возьмите щипцами небольшую стеклянную трубку (длиной около 10 см) и, хорошо прогрев ее в пламени горелки, поместите один конец ее над самым фитилем во внутреннем темном конусе пламени (рис. 38), а к другому концу трубки поднесите зажженную лучинку. Что наблюдаете? Что горит у верхнего конца трубки? Что находится во внутренней части пламени?
Опыт 4. Что находится в светящейся части пламени? Внесите в яркую часть пламени кусочек фарфора или какой-нибудь фарфоровый предмет. Выньте его из пламени. Что появилось на поверхности фарфора? Что содержится в светящейся части пламени?
12. Взаимодействие солей с металлами
Опыт 1. Налейте в одну пробирку около 2 мл раствора хлорида цинка, а в другую - столько же раствора нитрата свинца. В первую опустите кусочек свинца, предварительно очистив его поверхность ножом или напильником, а во вторую - кусочек цинка. Что наблюдаете? В какой из пробирок заметны изменения, свидетельствующие о происходящей реакции?
Опыт 2. Налейте в одну пробирку около 2 мл раствора хлорида цинка, а в другую - столько же раствора хлорида меди (II). В первую пробирку опустите кусочек меди, а во вторую - кусочек цинка. Проведите те же наблюдения, какие проводили при выполнении опыта 1.
Опыт 3. Налейте в одну пробирку около 2 мл раствора нитрата свинца, а в другую - столько же раствора хлорида меди (II). В первую пробирку опустите кусочек меди, а во вторую - кусочек свинца. Проведите те же наблюдения, какие проводили при выполнении первых двух опытов.
Выпишите, с какими солями вступали в реакцию: 1) цинк, 2) свинец, 3) медь. Напишите сокращенные ионные уравнения реакций.
13. Получение сплава олова со свинцом
Опыт 1. Положите в тигель кусочек олова и такой же кусочек свинца. Поместите тигель на кольцо штатива и нагрейте в пламени горелки. Когда металлы начнут плавиться, размешайте их проволокой. Получится однородная жидкость. Вылейте ее в углубление, сделанное в куске доски. После охлаждения до комнатной температуры рассмотрите кусочек полученного сплава олова со свинцом. Сравните твердость сплава с твердостью олова и свинца.
14. Окрашивание пламени солями натрия и калия
Опыт 1. Налейте в пробирку около 10 мл раствора хлорида натрия, а в другую пробирку - столько же раствора хлорида калия.
В пламени горелки тщательно прокалите железную проволоку. Смочите ее, опустив в пробирку с раствором хлорида натрия, и внесите в пламя горелки. В какой цвет окрасилось пламя?
Проволоку промойте в соляной кислоте и снова хорошо прокалите. Теперь смочите проволоку в пробирке с раствором хлорида калия и внесите в пламя горелки. В какой цвет окрасилось пламя?
15. Превращение карбоната кальция в бикарбонат кальция и бикарбоната в карбонат
Приготовьте прибор для получения двуокиси углерода.
Опыт 1. В пробирку налейте около 10 мл известковой воды и пропустите в нее двуокись углерода до помутнения. Какое вещество образовалось в растворе? Продолжайте пропускание двуокиси углерода, пока раствор не станет прозрачным. Какие реакции происходили при длительном пропускании двуокиси углерода в известковую воду? Напишите уравнения этих реакций.
Опыт 2. Полученный в пробирке раствор бикарбоната кальция разлейте в три пробирки. В одну из пробирок прилейте известковой воды, в другую - раствор карбоната натрия, а третью нагрейте до кипения. Что наблюдаете во всех трех пробирках? Объясните наблюдаемое. Напишите сокращенные ионные уравнения реакций.
16. Взаимодействие алюминия с кислотами и щелочами
Опыт 1. В две пробирки положите стружки или кусочки проволоки алюминия и прилейте в одну 3-4 мл раствора соляной кислоты, а в другую - столько же раствора серной кислоты. Если в какой-либо пробирке не будет происходить реакция, слегка подогрейте содержимое пробирки в пламени горелки. Что наблюдаете? Какой газ выделяется? Напишите сокращенные ионные уравнения реакций и укажите, что окисляется и что восстанавливается.
Опыт 2. В пробирку с 2-3 кусочками алюминия прилейте раствор едкого натра или едкого кали. Если не будет происходить реакция, то пробирку слегка подогрейте. Какой газ выделяется?
17. Получение гидроокиси алюминия; взаимодействие ее с кислотами и щелочами
Опыт 1. В две пробирки налейте по 2-3 мл раствора соли алюминия и прилейте в обе пробирки столько же раствора гидроокиси аммония. Что наблюдаете? Напишите сокращенные ионные уравнения реакций.
Опыт 2. В одну пробирку с осадком гидроокиси алюминия приливайте небольшими порциями раствор соляной кислоты, взбалтывая содержимое пробирки. Что наблюдаете? Объясните наблюдавшееся явление. Напишите сокращенное ионное уравнение реакции.
Опыт 3. В другую пробирку с осадком гидроокиси алюминия приливайте небольшими порциями раствор едкого натра, взбалтывая содержимое пробирки. Что наблюдаете? Объясните наблюдавшееся явление. Напишите сокращенное ионное уравнение реакции.
18. Испытание растворов солей алюминия индикатором
Опыт 1. Исследуйте раствор сульфата алюминия (или хлорида алюминия) на лакмус. Сделайте вывод на основании исследования о силе гидроокиси алюминия как основания. Напишите уравнение реакции гидролиза соли алюминия.
19. Получение гидроокиси хрома (III), взаимодействие ее с кислотой и щелочью
Проделайте опыты по получению гидроокиси хрома (III) и выяснению ее химических свойств, аналогичные тем, какие вы делали в работе 17. На основании проделанных опытов сделайте вывод, к каким гидроокисям следует отнести гидроокись хрома (III). Напишите соответствующие уравнения реакций; отметьте цвет осадка.
20. Превращение хроматов в бихроматы и бихроматов в хроматы
Опыт 1. В пробирку налейте 2-3 мл раствора хромата калия (обратите внимание на цвет раствора) и прилейте около 1 мл раствора серной кислоты. Как изменился цвет раствора?
Опыт 2. В пробирку к полученному раствору бихромата калия (какого цвета?) прилейте около 2 мл раствора едкого кали. Как изменился цвет раствора?
Какой вывод можно сделать об условиях перехода хромата в бихромат и бихромата в хромат?
21. Окислительные свойства бихроматов (хромовой смеси)
Опыт 1. В пробирку налейте 1-2 мл раствора бихромата калия (какого цвета?), добавьте около 1 мл раствора серной кислоты и 1-2 мл раствора сульфита натрия. Содержимое пробирки перемешайте. Как изменился цвет раствора? В какое валентное состояние перешел хром? Что окислилось и что восстановилось при этой реакции? Напишите уравнение реакции.
22. Взаимодействие окиси железа с кислотами
Опыт 1. Испытайте действие растворов кислот соляной, серной и азотной на окись железа. Что наблюдаете? Напишите сокращенные ионные уравнения реакций.
23. Получение гидроокисей двухвалентного и трехвалентного железа; взаимодействие их с кислотами
Опыт 1. Пользуясь имеющимися на столе реактивами, получите гидроокись железа (II) и гидроокись железа (III). Напишите сокращенные ионные уравнения реакций.
Опыт 2. Испытайте действие кислот на полученные гидроокиси железа. Напишите сокращенные ионные уравнения реакций.
24. Окисление двухвалентного железа
Опыт 1. Получите небольшое количество гидроокиси железа (II). Обратите внимание на цвет осадка. Наблюдайте изменение цвета гидроокиси железа (II) в местах соприкосновения ее с воздухом, объясните это явление и напишите уравнение реакции.
Опыт 2. В пробирку налейте около 2 мл раствора хлорида железа (II) и прилейте столько же хлорной воды. Как изменился цвет раствора? Объясните наблюдавшееся явление. Напишите сокращенное ионное уравнение реакции. Что окислилось и что восстановилось при этой реакции?
25. Взаимодействие солей трехвалентного железа с роданидом аммония и солей двухвалентного железа с красной кровяной солью
Опыт 1. К раствору хлорида железа (III) добавьте раствор роданида аммония NH4CNS (соли роданистоводородной кислоты HCNS). Как изменилась окраска раствора? Напишите сокращенное ионное уравнение этой реакции, учитывая, что один из продуктов реакции, роданид железа (III) Fe(CNS)3 мало диссоциирует на ионы.
Опыт 2. К раствору хлорида железа (II) добавьте раствор красной кровяной соли (железосинеродистый калий) K3Fe(CN)6. Что наблюдаете? Напишите сокращенное ионное уравнение этой реакции, учитывая, что один из продуктов этой реакции, железосинеродистое железо Fe3[Fe(CN)6]2, синего цвета, выпадает в осадок.
26. Испытание растворов солей железа индикатором
Исследуйте раствор хлорида железа (II) или сульфата железа (II) на лакмус. Сделайте вывод на основании исследования о силе гидроокиси железа (II), как основания. Напишите уравнение реакции гидролиза соли железа (II).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'