
Практические занятия
Работа 1. Решение экспериментальных задач по теме "Теория электролитической диссоциации"
Задача 1. Проделайте реакции между растворами:
- Na2CO3 и HNO3; CuCl2 и КОН; NaOH и H2SO4;
- Na2SO3 и HCl; MgCl2 и NaOH; КОН и HNO3;
- К2СO3 и H2SO4; CuSO4 и КОН; NaOH и HCl
Напишите ионные уравнения реакций и дайте объяснение.
Задача 2. В пробирки налейте по 1 мл растворов:
1) Pb(NO3)2, Na2SO4, KCl; 2) ZnSO4, Na2S, NaNO3; 3) AlCl3, K2CO3, Na2SO4. Каждый раствор исследуйте лакмусовой бумажкой. Дайте объяснение полученным результатам и напишите ионные уравнения реакций.
Задача 3. Проделайте реакции между: а) соляной кислотой и цинком; б) раствором иодида калия и хлорной водой; в) раствором сульфида натрия и бромной водой. Напишите ионные уравнения реакций (полные и сокращенные) и укажите, что окисляется и что восстанавливается при каждой реакции.
Задача 4. Пользуясь имеющимися на столе реактивами, получите: а) сульфат бария; б) гидроокись железа (III); в) карбонат магния. Напишите ионные уравнения реакций (полные и сокращенные) и дайте объяснение.
Работа 2. Получение солей аммония
Опыт 1.Получение нитрата аммония. Напишите уравнение реакции получения нитрата аммония.
- Приготовьте прибор, изображенный на рисунке 13.
- В колбу на 100 мл налейте 30-35 мл водного раствора аммиака, закройте ее пробкой с газоотводной трубкой, укрепите на штативе и соедините с U-образной трубкой.
- В U-образную трубку положите маленький кусочек лакмусовой бумажки и налейте через воронку раствора азотной кислоты ровно столько, сколько показано на рисунке 13 (большего количества наливать нельзя, так как кислоту во время опыта может выбросить током аммиака или засосать в колбу). Воронку оставьте в правом колене трубки для предупреждения выбрасывания брызг. U-образную трубку опустите в стакан со снегом или с холодной водой.
- Нагрейте осторожно раствор аммиака. Следите за тем, чтобы аммиак выделялся спокойно и полностью поглощался азотной кислотой. В соответствии с этим регулируйте нагревание водного раствора аммиака.
- Пропускайте аммиак до тех пор, пока жидкость не станет щелочной (лакмусовая бумажка окрасится в синий цвет). Тогда прекратите нагревание, жидкость из U-образной трубки вылейте в фарфоровую чашку и осторожно выпарьте до появления кристаллов нитрата аммония.
- Жидкость профильтруйте, а кристаллы нитрата аммония отожмите между листами фильтровальной бумаги и сдайте учителю.
Опыт 2.Получение сульфата аммония. Напишите уравнение реакции получения сульфата аммония.
- Соберите прибор, изображенный на рисунке 13.
- В колбу на 100 мл налейте 30-35 мл водного раствора аммиака, закройте ее пробкой с газоотводной трубкой, укрепите в штативе и соедините с U-образной трубкой.
- В U-образную трубку налейте через воронку раствора серной кислоты ровно столько, сколько показано на рисунке 13 (ни в коем случае не больше). Воронку оставьте в правом колене трубки для предупреждения выбрасывания брызг кислоты.
- Аммиак пропускайте в серную кислоту до тех пор, пока он не станет выделяться из правого колена трубки. Не допускайте, чтобы аммиак бурно прорывался через раствор серной кислоты.
- В U-образную трубку осторожно по стенке прилейте воды (4-5 мл), раствор вылейте в фарфоровую чашку и упарьте до появления кристаллов. Кристаллы перенесите на фильтр. Когда раствор стечет, промойте кристаллы на фильтре небольшим количеством холодной воды, отожмите между листами фильтровальной бумаги и сдайте учителю.
Работа 3. Определение минеральных удобрений
- Приготовьте таблицу для определения удобрений, помещенную на страницах 200-201 (начертите графы, напишите их названия и названия удобрений).
- Получите от учителя набор удобрений в пронумерованных пакетиках.
- Проведите испытания каждого удобрения, предусмотренные в таблице на страницах 200-201, полученные результаты запишите.
- Сравните записанные результаты с данными таблицы для определения удобрений и назовите удобрения.
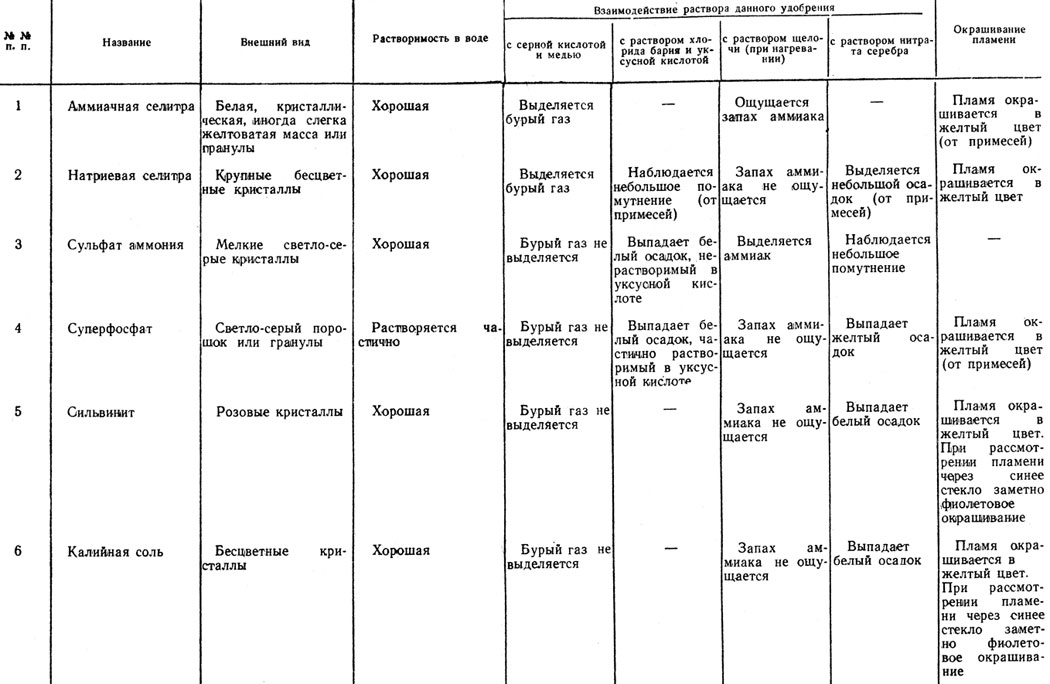
Таблица 15. Таблица для определения минеральных удобрений
Работа 4. Решение экспериментальных задач по теме "Азот и фосфор"
Задача 1. Проделайте реакции, характерные: 1) для аммиака, 2) для азотной кислоты, 3) для нитрата аммония.
Задача 2. Докажите экспериментальным путем, что сульфат аммония и нитрат аммония нельзя смешивать с известью перед внесением этих удобрений в почву, и объясните почему. Напишите уравнения реакций.
Задача 3. Докажите опытным путем, что: а) в состав хлорида аммония входят ионы аммония NH4+ и ионы хлора Сl-, б) в состав сульфата аммония входят ионы аммония NH4+ и ионы SО42-.
Задача 4. Вам выданы следующие удобрения: хлорид калия, аммиачная селитра и суперфосфат. На основании характерных реакций определите, в какой пробирке находится каждое из выданных веществ.
Задача 5. Из смеси, хлорида аммония, сульфата аммония и нитрата аммония получите аммиак.
Задача 6. Проделайте реакции, которые выражаются следующими ионными уравнениями:
- Н+ + ОН- = Н2O;
- Ba2+ + SO42- = BaSO4;
- Ag+ + Cl- = AgCl.
Задача 7. Получите нитрат меди тремя способами.
Работа 5. Определение молекулярного веса двуокиси углерода
- Взвесьте с точностью до 0,1 г сухую колбу вместе с подогнанной к ней пробкой (это вес колбы с воздухом).
- Наполните колбу из аппарата Киппа, или другого приготовленного прибора, двуокисью углерода. Для этого опустите трубку на самое дно колбы и пропускайте газ в течение 2-3 мин, чтобы полностью вытеснить из колбы воздух. Проверьте зажженной спичкой, наполнилась ли колба газом. Выньте трубку из колбы и закройте ее пробкой. Закройте кран аппарата Киппа. Пробка должна дойти до черты, отмеченной на горлышке колбы.
- Взвесьте колбу с двуокисью углерода. Вес колбы, с газом запишите.
- Чтобы убедиться, что весь воздух вытеснен из колбы газом, пропустите газ. второй раз в колбу и взвесьте. Если вес не изменился, наполнять третий раз не следует. Если же будет разница в весе, снова повторите наполнение колбы газом и снова взвесьте ее. Наполнение колбы газом прекратите лишь после того, как вес не будет изменяться.
- Измерьте объем колбы. Для этого в колбу налейте воды до отмеченной на горлышке черты, затем воду перелейте в мерный цилиндр, показание запишите.
- Запишите температуру по комнатному термометру и давление по комнатному барометру.
- Рассчитайте, какой объем занял бы заключенный в объеме колбы газ (при н. у.), по формуле:
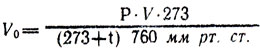
- Рассчитайте вес воздуха в объеме колбы, приняв средний молекулярный вес воздуха равным 29.
- Рассчитайте вес пустой колбы.
- Рассчитайте вес двуокиси углерода в объеме колбы.
- Рассчитайте молекулярный вес двуокиси углерода из полученных выше данных.
- Вычислите молекулярный вес двуокиси углерода по молекулярной формуле и выразите ошибку в процентах.
- Полученные в процессе работы числовые данные оформите в виде таблицы (табл. 16).

Таблица 16
Работа 6. Определение содержания карбонатов в известняке
- Приготовьте в тетради таблицу (табл. 17) для записи данных опыта.

Таблица 17 - Соберите прибор, изображенный на рисунке 74. Хлоркальциевую трубку наполните обезвоженным хлоридом кальция, поместив его между двумя рыхлыми комочками ваты.
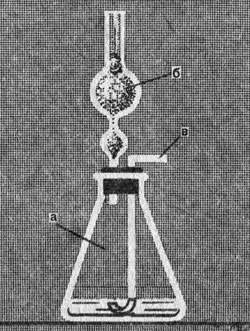
Рис. 74. Прибор для определения содержания карбонатов в известняке - Налейте в колбу 75 мл приготовленного 15-процентного раствора азотной кислоты. Колбу закройте пробкой с вставленной в нее хлоркальциевой трубкой.
- Взвесьте прибор на весах и вес запишите в таблицу.
- На чашку весов рядом с прибором положите несколько кусочков известняка величиной не больше горошины каждый, Общим весом около 5 г. Вес известняка запишите в таблицу.
- Откройте колбу, осторожно по стенке опустите в нее кусочки известняка и быстро закройте колбу.
- После полного "растворения" известняка присоедините к трубке 3 резиновую грушу и медленно продуйте через прибор воздух, чтобы вытеснить всю двуокись углерода. Водяные пары будут удерживаться хлоридом кальция.
- Взвесьте прибор и вес запишите в таблицу.
- Вычислите вес выделившейся двуокиси углерода.
- Вычислите вес карбонатов, вступивших в реакцию с кислотой.
- Рассчитайте содержание карбонатов во взятом образце известняка в процентах.
Работа 7. Решение экспериментальных задач по теме "Металлы"
Задача 1. В пробирках даны хлориды натрия, калия и магния. Определите опытным путем, какое вещество находится в каждой из пробирок.
Задача 2. Определите, в какой из выданных вам пробирок находится: хлорид железа (II), хлорид кальция, хлорид бария.
Задача 3. Докажите опытным путем, в какой из выданных вам пробирок содержатся растворы: хлорида алюминия, хлорида железа (III), хлорида бария, сульфата железа (II).
Задача 4. Докажите опытным путем, что железный купорос, образец которого вам выдан, содержит примесь сульфата железа (III).
Задача 5. Докажите опытным путем, что выданное вам вещество есть хлорид железа (III).
3адача 6. Проведите реакции, характерные для ионов двухвалентного и трехвалентного железа.
Задача 7. Получите гидроокись хрома (III) и докажите опытным путем, что она обладает амфотерными свойствами.
Задача 8. Выданная вам вода содержит вещества, придающие ей постоянную и временную жесткость. Проделайте опыты, показывающие способы смягчения этой воды.
Задача 9. Взяв в качестве исходного вещества хлорид железа (III), получите окись железа.
Задача 10. Исходя из алюминия, получите раствор алюмината натрия.
Задача 11. Исходя из железа, получите хлорид железа (II).
Задача 12. Очистите железный гвоздь от ржавчины химическим способом.
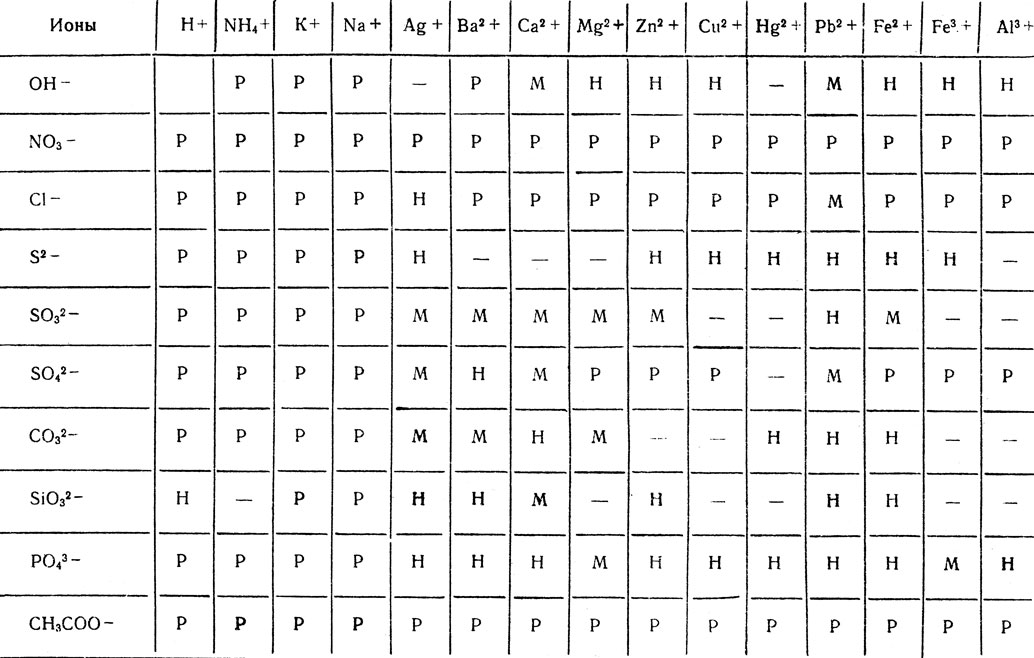
Растворимость солей, кислот и оснований в воде. Р - растворимые (больше 1 г в 100 г воды); М - малорастворимые (от 1 г и до 0,001 г в 100 г воды); Н - нерастворимые (меньше 0,001 г в 100 г воды); черточка - разлагаются водой или не существуют
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'