
Структура белков
Выяснение особенностей структуры белков представляет собой важную и не менее сложную задачу. Это связано с тем, что знание закономерностей строения белков позволит проникнуть в тайны живого, даст в руки людей методы и способы, с помощью которых будет осуществлен искусственный синтез белка - основного носителя жизни. Вот почему изучению структуры белка уделялось и уделяется сейчас самое большое внимание, вот почему решению этой задачи отдали свой труд, все свои силы многие ученые мира. И первым, кто внес значительный вклад в дело изучения этого вопроса, был наш отечественный ученый профессор А. Я. Данилевский. В своих работах, опубликованных в 1888 г., он высказал предположение, что аминокислоты, входящие в состав белка, соединяются между собой при помощи пептидной связи:
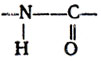
Качественной реакцией на существование такой связи является биуретовая реакция.
В дальнейшем предположение А. Я. Данилевского было подтверждено экспериментально. Эта связь образуется NH2-группой одной аминокислоты и СООН-группой другой:
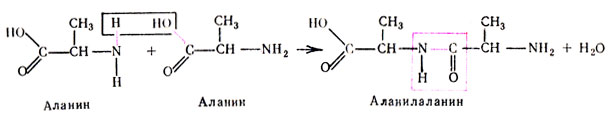
Соединение, состоящее из двух аминокислот, называется дипептидом, из трех - трипептидом и т. д.
Впервые полипептид из 19 аминокислот удалось синтезировать Э. Фишеру. Некоторые из полученных им полипептидов оказались тождественными с полипептидами, получаемыми при гидролизе природных белков.
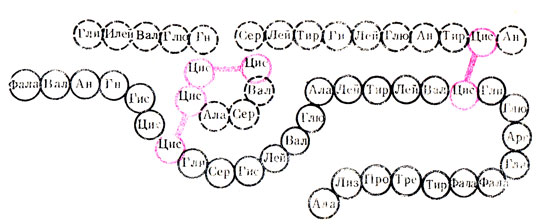
Рис. 12. Первичная структура инсулина
Однако дальнейшее изучение структуры белков стало возможным только в 40-50-х годах нашего столетия, когда на помощь ученым пришли новые методы исследования, такие, как рентгеноструктурный анализ, различные виды хроматографии, электрофорез, метод двойного лучепреломления и др. В результате этих исследований было установлено, что каждый белок имеет в своем составе известное количество определенных аминокислот, соединенных между собой в строго зафиксированной последовательности при помощи пептидных связей. Эта уникальная, специфичная для каждого белка последовательность аминокислот была определена как первичная структура белка. В настоящее время для ряда белков определена их первичная структура. Например, для инсулина - гормона поджелудочной железы белковой природы - установлена последовательность 51 аминокислотного остатка, входящего в его состав, что позволило получить его искусственным путем. На рис. 12 представлена первичная структура инсулина. Черные линии между молекулами цистеина - дисульфидные связи. В настоящее время выяснено, в какой последовательности соединяются 129 остатков аминокислот, входящих в состав рибонуклеазы - фермента, расщепляющего РНК.
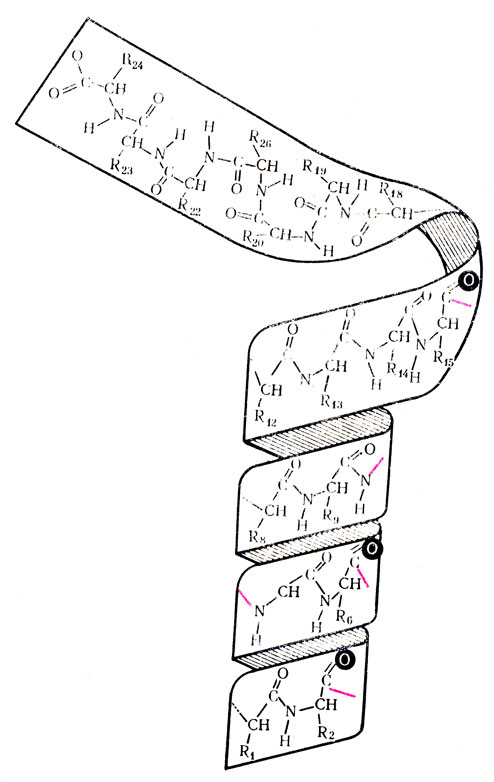
Рис. 13. Молекулярная модель полипептидной цепи, свернутой в спираль
Дальнейшие исследования показали, что полипептидная цепь находится в молекуле белков в закрученном состоянии в виде α-спирали (рис. 13). Впервые такое предположение было выдвинуто Л. Полингом и подтверждено в последующих работах экспериментально. Спирализация полипептидной цепи обеспечивается водородными связами, которые возникают между аминными и карбоксильными группами, расположенными на противоположных витках спирали. Водородная связь представляет собой соединение за счет водорода, находящегося между двумя сильно отрицательными атомами. Это видно на примере воды (пунктирная линия обозначает водородную связь, образованную между двумя атомами кислорода):
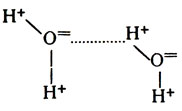
Во вторичной структуре белков эту связь схематично можно представить следующим образом
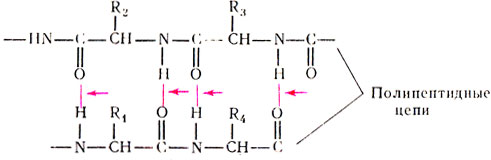
Стрелками обозначены водородные связи.
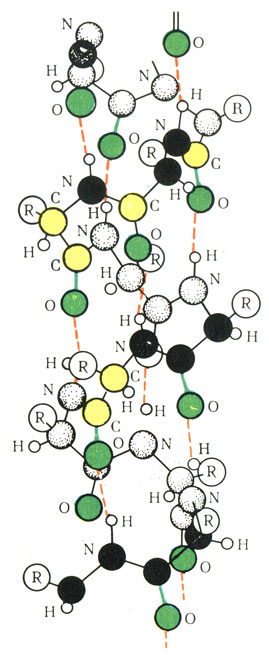
Рис. 14. Участок вторичной структуры белка. Пунктирные линии обозначают водородные связи
Такое расположение полипептидной цепи было определено как вторичная структура белка. Схематично она представлена на рис 14.

Рис. 15. Трехмерная модель гемоглобина, иллюстрирующая третичную структуру. Темные диски - гематиновые группы (по Кендрю)
Пространственное взаиморасположение участков спиралей полипептидных цепей определяется как третичная структура (рис. 15 и 16). Основным видом связи, удерживающим спирали в определенном положении, является дисульфидная связь, которая возникает между двумя молекулами цистеина:
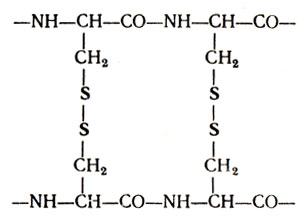
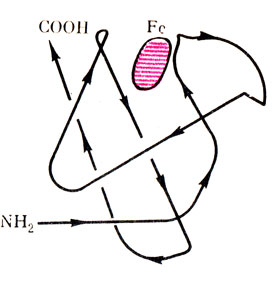
Рис. 16. Третичная структура миоглобина. Направление полипептидной цепи
Это довольно прочная связь, которая может разрываться под действием сильных факторов, таких, как высокая температура - 80-90°, сильные кислоты или щелочи, алкоголь и др. При денатурации белка происходит разрыв дисульфидных связей и раскручивание полипептидной цепи (см. рис. 16).
Следует отметить, что указанные выше типы связей являются определяющими для каждого уровня организации белковой молекулы, но они встречаются и на других структурах. В молекуле белков имеются и иные типы связей, например различные ковалентные связи, силы Ван-дер-Ваальса и т. д.
Молекулы многих белков состоят из нескольких индивидуальных полипептидных цепей, определенным образом связанных друг с другом. Каждая из них может иметь свою собственную первичную, вторичную и третичную структуры. К таким белкам относится гемоглобин, молекула которого состоит из 4 полипептидных цепей и не содержит ни одного дисульфидного мостика. О таких белках говорят, что они обладают четвертичной структурой.
В зависимости от пространственною расположения полипептидной цепи (третичная структура) молекулы белков могут быть различной формы. Если полипептидная цепь уложена в виде клубка, то молекула белка имеет в сущности шаровидную форму. Такие белки называются глобулярными (лат. globulus - шарик). В другой группе белков полипептидные цепи образуют молекулы нитевидной формы и белки называются фибриллярными (лат. fibrilla - нить). Эти белки различаются и по своим свойствам. Так, глобулярные белки хорошо растворимы в воде, фибриллярные - плохо или совсем не растворимы. Представителями глобулярных белков являются яичный белок, казеин молока, белки сыворотки крови и т. д. К фибриллярным белкам относятся белки опорных тканей: белки мышц - миозин, белки костей - оссеин, кератин, крови - фибрин и др.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'