
Представление о катализе
Катализ - это процесс изменения скорости химической реакции под влиянием различных веществ - катализаторов, участвующих в этом процессе и к концу реакции остающихся химически неизмененными. Если от добавления катализатора происходит ускорение химического процесса, то такое явление называют положительным катализом, а замедление реакции- отрицательным. Чаще всего приходится встречаться с положительным катализом. В зависимости от химической природы катализаторы разделяются на неорганические и органические. К последним относятся и биологические катализаторы - ферменты.
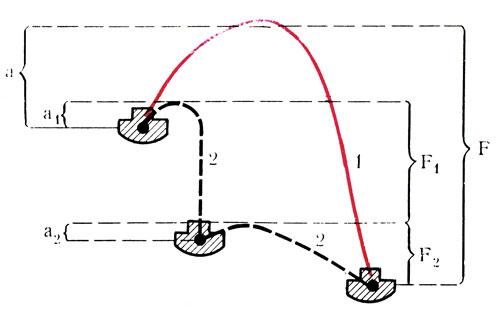
Рис. 37. Схематическое изображение некатализируемой (1) и катализируемой (2) реакций (объяснение в тексте)
Для понимания действия катализаторов необходимо кратко остановиться на рассмотрении сущности катализа. Скорость любой химической реакции зависит от числа столкновений активных молекул реагирующих веществ. Активированной называется молекула, которая имеет определенный запас потенциальной энергии. Взаимодействие двух таких молекул произойдет только в том случае, если запас энергии этих молекул будет достаточным для преодоления сил отталкивания между ними - так называемого "энергетического барьера" реакции (рис. 37, F, F1, F2). Если реагирующие молекулы будут обладать большей величиной энергии, чем энергетический барьер, то реакция произойдет. Если же запаса энергии реагирующих молекул будет недостаточно для преодоления энергетического барьера, то они не будут взаимодействовать. В этом случае для протекания реакции необходимо активировать молекулы, т. е. сообщить им дополнительное количество энергии, которое в сумме с имеющейся потенциальной энергией в молекулах будет достаточным для преодоления энергетического барьера. Это дополнительное количество энергии называется "энергией активации" (см. рис. 37, а, а1, а2). Активировать молекулы можно путем нагревания, повышения давления, облучения и т. д.
Сущность действия катализаторов заключается в том, что, во-первых, они обладают способностью активировать молекулы реагирующих веществ, и, во-вторых, взаимодействие молекул (или веществ) происходит не в один, а в несколько этапов.
При этом энергетический барьер каждой из промежуточных реакций будет ниже энергетического барьера исходной реакции. Схематично это можно представить следующим образом.
Исходную реакцию некатализируемую (рис. 37,1) между веществами А и В можно записать как
А + В → АВ (1)
Энергетический барьер этой реакции можно обозначить как F, а энергию активации - а. В случае введения в эту систему катализатора (К) (см. рис. 36,2) на первом этапе (21) произойдет взаимодействие одного из веществ с катализатором:
А + К → АК (2)
Энергетический барьер этой реакции, обозначенный как F1, и энергия активации - а1 будет меньше энергетического барьера исходной реакции (1) F1<F, a1<а и соответственно энергии активации.
На втором этапе (22) произойдет образование конечного продукта исходной реакции и катализатор выделится в неизмененном виде:
АК + В → АВ + К (3)
В этой реакции, энергетический барьер которой обозначим как F2, F2<F, а энергия активации а2<а.
Суммируя 2-ю и 3-ю реакции, получим:
А + В + К → АВ + К (4)
Таким образом, в ходе реакции с катализатором образовались те же продукты, что и в исходной реакции (1), но с энергетической точки зрения эта реакция более выгодна, так как F1 + F2<F. Особенно это заметно по энергии активации (а1 + а2<а). Следовательно, катализируемая реакция, хотя и идет в 2 этапа, но при этом требуется меньше энергии и значительно снижается энергия активации по сравнению с некатализируемой реакцией.
Катализаторы являются очень активными соединениями, и химические реакции при их участии идут очень быстро, в основном за счет снижения энергии активации. Так, если, например, скорость разложения Н2О2 без катализатора принять за единицу, то в присутствии катализатора - платиновой черни (неорганический катализатор) скорость реакции увеличивается в 2*104 раза, а энергия активации снижается соответственно с 18 ккал/моль до 12 ккал/моль. Таким образом, оказывается, что катализатор не только снижает энергетические затраты на течение реакций, но и значительно повышает их скорость.
К основным характеристикам катализа относятся следующие:
- катализаторы могут ускорять (положительный катализ) только те химические реакции, которые вообще могут идти по своим термодинамическим законам,
- катализаторы не изменяют направление хода химической реакции, а только ускоряют достижение состояния равновесия.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'