
Специфичность ферментов
Одним из основных свойств ферментов, отличающих их от других катализаторов, является высокая специфичность, которая заключается в том, что каждый фермент может катализировать одну или несколько близких по своей природе химических реакций. Специфичность основана на строгом соответствии структуры субстрата и того участка фермента, с которым он. соединяется. По образному выражению Э. Фишера, фермент должен подходить к субстрату, как ключ подходит к замку. В последние годы вскрыты более тонкие механизмы взаимодействия субстрата и фермента (Кошленд и др.).
Специфичность ферментов условно подразделяется на несколько видов:
- Относительной специфичностью обладают ферменты, которые действуют на соединения, имеющие определенный тип связи. Например, протеиназы гидролизуют все соединения, имеющие в своем составе пептидную связь -СО-NH-, эстеразы расщепляют эфирную связь -О- и т. д. Ферменты, обладающие относительной специфичностью, являются ферментами широкого спектра действия.
- Групповая специфичность характерна для ферментов, которые действуют на субстраты, имеющие одинаковый тип связи и одну из функциональных группировок. К их числу относятся:
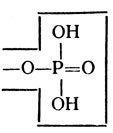
- фосфомоноэстеразы, гидролизующие субстраты следующей структуры:
Для их действия обязательным условием является наличие эфирной связи (-О-) и остатка фосфорной кислоты
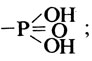
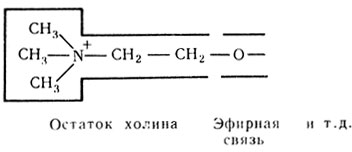
- холинэстеразы, в субстратах которых имеются определенные группировки (эфирная связь и остаток холина):
- фосфомоноэстеразы, гидролизующие субстраты следующей структуры:
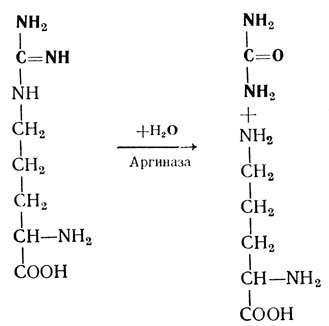
- Абсолютная специфичность характеризует ферменты, действующие только на один субстрат с вполне определенной структурой. Например: аргиназа расщепляет аргинин на орнитин и мочевину по следующей схеме:
К ферментам, обладающим абсолютной специфичностью, относятся также уреаза, анетилхолинкгераза и др.
Следует выделить в отдельный вид специфичности и стереохимическую, при которой фермент будет действовать только на определенный сгереоиюмер субстрата.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'