
Активаторы и ингибиторы ферментов
Каталитическая функция ферментов зависит от влияния различных веществ, одни из которых повышают скорость реакций, и активность ферментов возрастает, а другие - ее затормаживают, т. е. ингибируют.
Первые из них нЖываются активаторами ферментов. Например, ионы хлора активируют амилазу слюны, ионы водорода - пепсин, ионы цинка - карбангидразу. Желчные кислоты являются активаторами для кишечной липазы и т. д. Наряду с процессом активации ферментов существует и процесс самоактивации (аутоактивации). Так, в желудке вырабатывается неактивный фермент пепсиноген. Он является предшественником (проферментом) пепсина. Активация пепсиногена заключается в том, что уже имеющийся в желудке активный фермент - пепсин действует на пепсиноген и отщепляет от его молекулы полипептид с молекулярным весом 7000. Оставшаяся часть молекулы пепсиногена приобретает определенную форму, характерную для активного фермента - пепсина. Аналогичным путем происходит активирование и некоторых других ферментов (например, трипсина).
Вещества, способные угнетать действие ферментов, называются парализаторами, или ингибиторами (I). Механизм действия ингибиторов в общем виде заключается в том, что ингибитор вступает в соединение с ферментом, образуя неактивный фермент-ингибиторный комплекс (EI) вместо активного фермент-субстратного (ES), что приводит к блокированию фермента. Торможение активности ферментов ингибиторами может быть обратимым и необратимым. В последнем случае ингибитор, являясь денатурирующим агентом, приводит к полному изменению структуры фермента, его инактивации. К таким ингибиторам относятся сильные кислоты и щелочи, спирт, цианистые соли и т. д.
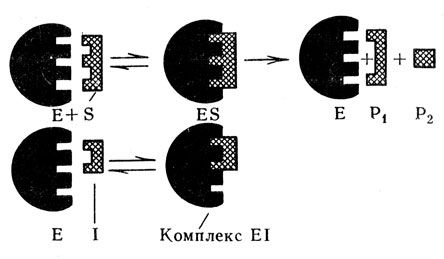
Рис. 40. Схема действия конкурентного ингибитора (объяснение в тексте)
Различают также конкурентное и неконкурентное ингибирование. Конкурентное торможение возможно в том случае, когда ингибитор имеет структуру, близкую структуре субстрата, т. е. является его структурным аналогом. В основе этого вида торможения лежит конкуренция между субстратом и ингибитором за обладание ферментом. В результате этого ингибитор обратимо взаимодействует с тем участком в молекуле фермента, с которым. обычно соединяется субстрат (рис. 40). Из рисунка видно, что между молекулами фермента и субстрата имеется структурное соответствие, которое обеспечивает образование активного фермент-субстратного комплекса. Последний затем расщепляется с образованием продуктов реакции, а фермент выделяется в неизмененном виде. В случае конкурентного торможения ингибитор (структурный аналог субстрата) присоединяется к ферменту в том же участке, что и субстрат, в результате чего субстрат уже не может соединиться с ферментом. Конкурентное ингибирование обратимо и зависит от концентрации ингибитора и субстрата. Если концентрация ингибитора (I) выше, чем субстрата (S), т. е. [I]>[S], образуется фермент-ингибиторный комплекс Е + S + I → EI + S и расщепления субстрата не произойдет. Но в случае избытка субстрата - [S]>[I], последний вытеснит ингибитор из фермент-ингибиторного комплекса и образуется фермент-субстратный комплекс с последующим распадом субстрата на продукты реакции:
Е + S + I → ES + I → Е + Р + I.
Таким образом, конкурентное торможение - это такое торможение, когда ингибитор обратимо соединяется с ферментом в том участке его молекулы, в котором присоединяется и субстрат (активный центр), причем между субстратом и ингибитором существует количественное взаимоотношение. Классическим примером конкурентного торможения служит конкуренция между янтарной кислотой - субстрат и малоновой- ингибитор за фермент сукцинатдегидрогеназу, которая катализирует образование фумаровой кислоты из янтарной:

При неконкурентном торможении ингибитор соединяется с ферментом не по месту присоединения с субстратом (не с активным центром), а где-то в другом участке молекулы фермента, что приводит, к значительному снижению активности фермента и даже к его ингибированию. Таким примером является действие синильной кислоты на железосодержащие ферменты, осуществляющие перенос электронов при окислительно-восстановительных реакциях.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'