
Общие представления о механизме действия ферментов
Механизм действия ферментов пока изучен недостаточно, однако имеющиеся данные позволяют высказать о нем общее представление.
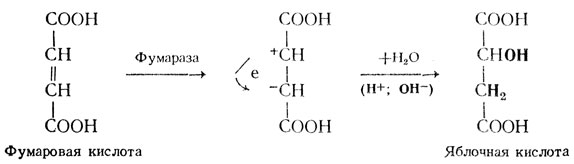
В основе действия ферментов как биологических катализаторов лежит их способность повышать скорость реакции за счет снижения энергии активации субстрата, т. е. каким-то образом его активировать. Это достигается при взаимодействии субстрата с ферментом, который вызывает какие-либо изменения в молекуле субстрата, в результате чего он становится активным (реакционноспособным). Следовательно, необходимым условием для активации субстратов и понимания механизма действия ферментов является образование фермент-субстратного комплекса. Пути и механизмы, приводящие к активированию субстрата, могут быть самыми различными и зависят от структуры ферментов. В качестве примера можно привести предполагаемый механизм действия фумаразы - фермента-протеина, который вызывает активирование фумаровой кислоты, вследствие чего к ней присоединяется молекула воды и образуется яблочная кислота.
В фумаровой кислоте имеется двойная связь, которая представлена парами электронов. Под действием фумаразы происходит их перераспределение, что приводит к появлению зарядов на молекуле субстрата (субстрат активируется). Последний становится способным присоединять ионы (Н+ и ОН-) по типу электростатической связи:
При изучении механизма действия сложных ферментов оказалось, что в процессе активации субстрата принимает участие и небелковая часть - кофермент. Кроме того, было обращено внимание на следующие обстоятельства. Одно из них заключается в том, что молекула фермента во много раз больше молекулы субстрата, и поэтому субстрат не может быть связан со всей молекулой фермента. Второе обстоятельство характеризуется тем, что при отщеплении от молекулы фермента определенного количества аминокислот фермент продолжает катализировать те же самые реакции с высокой скоростью, что и нерасщепленный фермент. Например, при удалении из молекулы папаина (фермента, катализирующего распад белков в растениях) 120 из 180 аминокислот, входящих в состав его молекулы, фермент сохранял свои каталитические способности.
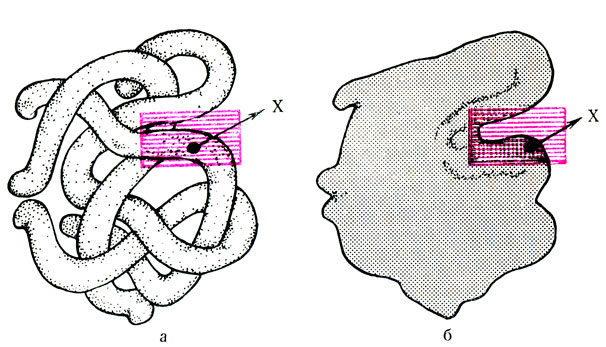
Рис. 41. Модель молекулы фермента. а - схема ее гретичной структуры; б - силуэт молекулы с активным центром (обведен пунктиром) и его 'каталитически активным' центром (х)
Эти факты привели к выводу о том, что фермент взаимодействует с субстратом не всей своей молекулой, а каким-то вполне определенным участком, расположенным на поверхности фермента (на третичной структуре). Этот участок был назван активным центром (рис. 41). В составе активного центра условно выделяют несколько участков, одни из которых обеспечивают присоединение субстрата к молекуле фермента (их называют контактными, или якорными, участками), другие - каталитические - ответственны за процесс активации субстрата. В этих участках имеются различные функциональные группировки, которые находятся в строго зафиксированном положении по отношению друг к другу. Эта особенность строения активного центра объясняет специфичность действия ферментов, так как образование фермент-субстратного комплекса возможно только в случае структурного подобия субстрата и активного центра фермента.
Под действием различных факторов (высокая температура, изменение рН среды, химические вещества) нарушается структура активного центра и фермент теряет способность взаимодействовать с субстратом, т. е. фермент инактивируется.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'