
3. Условия возникновения и течения химических реакции
Изучаемый в IX-X классах материал предоставляет большие возможности для развития понятий об условиях возникновения и течения реакций: здесь учащимся следует показать, что некоторые химические превращения возникают и происходят под действием света; про-вести некоторое обобщение знаний о связи между условиями реакций и их тепловыми эффектами (экзо- или эндотермичностью процесса); дать объяснение влиянию энергии на возбуждение химических превращений; выяснить сущность явлений электролиза. Кроме того, на уроках необходимо формировать понятия о действии условий на изменение скорости и направления химических реакций.
В темах "Щелочные металлы" и "Галогены" учитель уделяет внимание условиям изучаемых химических реакций, указывая на эти условия при демонстрации или проведении лабораторных опытов.
В теме "Галогены" следует показать, что условием возникновения и течения реакции может быть действие света. При изучении химических свойств хлора демонстрируют горение водорода в хлоре, затем при разборе способов получения хлористого водорода - взрыв смеси водорода с хлором при ярком освещении. Во втором случае отмечают, что взаимодействие водорода с хлором может происходить не только при нагревании, но и при действии яркого света, который возбуждает химическую реакцию.
В той же теме, рассматривая соли соляной кислоты, проводят опыт разложения хлористого серебра на свету. Для этого только что полученный осадок соли отфильтровывают, промывают водой, фильтр с осадком вынимают из воронки. Хлористое серебро разравнивают на фильтре, на середину слоя кладут металлическую пластинку и выставляют на свет. На следующем уроке учащиеся видят, что осадок под пластинкой остался светлым, а вокруг нее потемнел.
Когда выяснено, что свет - условие разложения хлористого серебра, сравнивают эту реакцию с другой, про-исходящей также под действием света,- взаимодействием хлора с водородом. Отмечают, что хлористое серебро под влиянием света разлагается постепенно, а взрыв смеси хлора с водородом происходит при кратковременном ярком освещении смеси. Разложение хлористого серебра- эндотермическая реакция, а взаимодействие хлора с водородом - экзотермическая.
Значение энергетических условий для возникновения и течения реакций объясняется далее в свете теории строения атомов. При изучении темы "Перйодический закон и перйодическая система химических элементов Д. И. Менделеева. Строение вещества" внимание учащихся обращают на то, что различные электроны, находящиеся в атоме, могут обладать различным запасом энергии, так как находятся на разных энергетических уровнях. Чем дальше от ядра движется электрон, тем большим запасом энергии он обладает, тем легче может быть отделен от атома. Поэтому в образовании новых электронных пар при химических реакциях участвуют обычно внешние (валентные) электроны. Если затратить энергию, можно переместить электроны в атоме на более высокие уровни. Однако такое состояние атома будет неустойчивым, и он будет более активным. При определенных условиях электроны перемещаются в прежнее положение, выделяется энергия.
В теме "Растворы. Основы теории электролитической диссоциации" рассматривают, почему растворение веществ представляет собой условие, необходимое для течения многих реакций обмена между кислотами, основаниями и солями. Здесь же при изучении вопроса "Электролиз растворов и расплавов" закрепляют полученное еще в VII классе понятие о том, что химическое превращение может происходить под влиянием электрического тока; химические действия тока объясняют в свете теории строения атомов*.
* (Методика изучения вопроса "Электролиз растворов и расплавов" изложена в кн.: Т. М. Дризовская. Методика обучения химии в IX классе. М., "Просвещение", 1965)
Для обобщения знаний о связи между тепловыми эффектами химических реакций и условиями, при которых реакции осуществляются, используют таблицу (стр. 67).
Рассматривая примеры химических превращений, указанные в таблице, приходят к выводу, что если реакция эндотермическая, то любой из используемых для ее про-ведения видов энергии нужно подводить к веществам все время? в случае экзотермической реакции, идущей с выделением больших количеств теплоты, любой из используемых для ее осуществления видов энергии нужно применять только для начала химического превращения. Поясняя вывод, следует сказать, что возникающая при химическом превращении теплота может быть меньше ее потерь. Тогда для поддержания температуры, необходимой для реакции, приходится применять все время внешнее энергетическое воздействие.
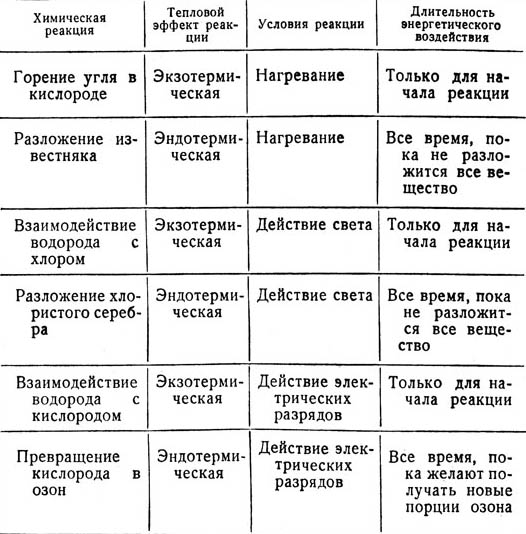
Условия химических реакций и их тепловые аффекты
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'