
4. Скорость химической реакции
В IX-X классах средней школы продолжают формировать понятия о скорости химической реакции, о влиянии на скорость химических превращений различных факторов, расширяют и углубляют знания о катализе и катализаторах, дают некоторые представления о механизме каталитических явлений.
В теме "Щелочные металлы", демонстрируя такие опыты, как взаимодействие натрия с водой и соляной кислотой, взаимодействие калия и натрия с водой, учитель подчеркивает, что одни из этих реакций идут в тех же условиях быстрее, чем другие. Например, натрии энергичнее реагирует с соляной кислотой, чем с водой; калий энергичнее реагирует с водой, чем натрий. После опытов горения в хлоре натрия, меди, сурьмы, водорода, органических веществ можно предложить вопросы: "Почему для горения в хлоре был взят порошок сурьмы, а не кусочки? Почему пучок тонкой медной проволоки горит в хлоре, а толстая проволока не горит?" В этих случаях различие во взаимодействии веществ объясняется, либо природой самих веществ и строением атомов, либо различной поверхностью соприкосновения.
В той же теме при ознакомлении учащихся со свойствами соляной кислоты полезно выяснить, почему реакции между этой кислотой и металлами (цинком, магнием) с течением времени ускоряются. Ускорение зависит, в частности, от того, что при данных реакциях выделяется большое количество теплоты, а с нагреванием веществ скорость взаимодействия увеличивается.
На примере реакции взаимодействия алюминия с йодом следует напомнить, что такое катализатор, и показать, что катализатором может быть вода. Смесь порошков йода и алюминия насыпают на асбестовую сетку горкой и приливают несколько капель воды. Взаимодействие веществ под влиянием воды ускоряется, вспыхивает пламя. Учитель обращает внимание на то, что в смеси, которая не высыпана из фарфоровой чашки на сетку, вспышка не произошла, но она может произойти спустя некоторое время и без воды.
Необходимо отметить, что вода ускоряет не только взаимодействие алюминия с йодом, но играет каталитическую роль во многих Химических процессах. Очень важно каталитическое действие воды при горении различных газов, применяемых в технике.
При рассмотрении свойств перекиси водорода указывают, что перекись водорода - вещество очень непрочное. При хранении в стеклянной посуде она медленно разлагается с выделением теплоты:
2Н2O2 = 2Н2O4 + O2 + 46 ккал
Учитель предлагает учащимся перечислить условия, ускоряющие разложение перекиси водорода. Они могут
указать в этом случае: 1) нагревание, 2) действие катализаторов, 3) увеличение концентрации раствора. Можно добавить, что разложение перекиси водорода идет быстрее также на свету, подтвердить это опытом на внеклассных занятиях. В две укрепленные в штативах колбы налить перекись водорода, закрыть их пробками с газоотводными трубками. Трубки подвести под опрокинутые цилиндры или пробирки, наполненные водой и опущенные в широкий сосуд с водой. Одну из колб обернуть черной бумагой. Приборы выставить на освещенное солнцем окно или освещать электрической лампой в 75- 100 в. Опыт покажет быстрое разложение перекиси водорода под действием света.
Затем учащиеся на уроке самостоятельно изучают изменение скорости разложения перекиси водорода под действием катализаторов. Для работы выдают 3-5-процентный раствор перекиси водорода, двуокись марганца, концентрированную соляную кислоту, лучинку, воронку, фильтровальную бумагу, несколько пробирок.
Задания: 1) Проверить, идет ли разложение перекиси водорода в том растворе, который выдан? 2) Применяя двуокись марганца, ускорить реакцию разложения перекиси водорода. 3) Доказать, что в результате реакции двуокись марганца химически не изменилась* 4) Доказать, что двуокись марганца, уже применявшаяся в качестве катализатора, может снова ускорить разложение перекиси водорода.
* (Проба соляной кислотой при нагревании. )
После окончания самостоятельной работы учитель показывает, что для ускорения одной и той же химической реакции можно применять различные катализаторы, что разложение неорганического вещества (перекиси водорода) ускоряется органическими катализаторами- ферментами. В небольшой химический стакан наливают 3-процентный раствор перекиси водорода, затем в него помещают небольшой кусочек сырого мяса. Из раствора интенсивно выделяется кислород, так как в крови и тканях животных содержится фермент-каталаза. Следует подчеркнуть, что ферменты - прекрасные природные ускорители реакций. Одна из важных задач химии будущего состоит в искусственном получении и применении в промышленности катализаторов, которые будут напоминать ферменты по своему составу и каталитическим свойствам.
Чтобы объяснить, почему разложение перекиси водорода идет быстрее при хранении в стеклянной посуде, проводят опыт. В три пробирки наливают раствор перекиси водорода, в одну из них прибавляют раствор серной кислоты, в другую - едкого натра, третью оставляют для сравнения (контрольный раствор). Все три раствора нагревают (не до кипения). Будет сильно выделяться кислород из пробирки с растворами перекиси водорода и едкого натра, менее сильно - из пробирки с контрольным раствором. В присутствии серной кислоты (ионов водорода) перекись водорода не разлагается. Ионы ОН катализируют процесс разложения перекиси водорода, поэтому в стеклянной посуде, стенки которой выделяют в раствор ионы гидроксила, перекись водорода легко разлагается.
Закрепление и развитие знаний о скорости химической реакции продолжается и дальше. Пропуская смесь двуокиси серы и кислорода через нагретую стеклянную без катализатора трубку, учитель показывает, что образование серного ангидрида при этих условиях не заметно, и спрашивает учащихся, как можно ускорить взаимодействие газов. В беседе выясняется, что такие приемы ускорения реакций, как увеличение концентраций реагентов, повышение температуры, без применения катализатора не дают необходимых результатов. Реакция окисления сернистого ангидрида в серный обратима:
2SO2 + O2 ↔ 2SO3 + Q,
и повышение температуры ускоряет в большей степени разложение серного ангидрида, чем его образование.
Проверяют, будет ли окись железа катализатором для реакции окисления сернистого газа. При демонстрации контактного окисления сернистого газа в серный ангидрид в присутствии окиси железа наблюдают получение серного ангидрида, дымящего на воздухе. Затем устанавливают, что в результате реакции окись железа химически не изменилась. Для этого повторяют опыт контактного окисления сернистого газа в серный ангидрид с той же порцией окиси железа. Далее отмечают, что для ускорения окисления сернистого газа можно использовать разные катализаторы. Кроме окиси железа, в химической промышленности применяли платину, а теперь используют пятиокись ванадия V2O5*.
* (Ванадиевый катализатор, применяемый в настоящее время, имеет сложный состав (см.: Д. А. Эпштейн. Учителю химии о кимической технологии, М., Изд-во АПН РСФСР, 1961).)
Важно также подчеркнуть свойство катализатора, ускоряя реакцию, не оказывать влияния на ее обратимость: реакция окисления сернистого ангидрида в серный и в случае использования катализатора остается обратимой.
При изучении контактного способа производства серной кислоты нужно рассмотреть использование катали-затора в промышленности. Без катализатора быстрое получение больших количеств серного ангидрида было бы невозможно, но его применение вызывает некоторые дополнительные требования к условиям процесса. Дело в том, что примеси к реагирующим веществам отрицательно влияют на катализатор. На ванадиевый катализатор отрицательно действует, как говорят, "отравляет" его, трехокись мышьяка. Поэтому необходима тщательная очистка реагирующих газов от примеси.
Если у учащихся возникнет вопрос, почему происходит отравление катализатора, то учитель сначала объясняет его действие с помощью теории образования про межуточных соединений, а затем уже рассматривает отравляющее влияние примесей.
Ускорение реакций с помощью катализатора происходит благодаря тому, что он образует непрочные соединения с исходными веществами, а затем снова выделяется в свободном виде. Эти реакции идут значительно быстрее, чем реакция взаимодействия сернистого газа с кислородом. Если в смеси газов есть примеси, вступающие с катализатором в необратимые реакции, то происходит его отравление. Несмотря на тщательную очистку газов, активность катализаторов, применяемых в производстве серной кислоты, с течением времени уменьшается. "Старение" его вызывается не только постепенным отравлением, но и длительным нагреванием, и механическим разрушением, которые изменяют состояние поверхности катализатора. В катализируемой реакции участвует не вся поверхность катализатора, а только отделаные ее участки - активные центры, а число этих центров при "старении" уменьшается.
В предыдущем разделе разобрано, как в свете теории строения атомов следует объяснить учащимся действие энергии на возбуждение химической реакции. Это даст возможность решить вопрос, почему химические реакции ускоряются при нагревании. Учащиеся знают, что при повышении температуры в веществах увеличивается количество активных молекул, растет скорость движения молекул и число их встреч в единицу времени. В атомах активных молекул электроны перемещены на более высокие энергетические уровни, такие молекулы неустойчивы и легче могут реагировать с молекулами других веществ.
Теория электролитической диссоциации позволяет объяснить, почему реакции между растворами кислот, солей и оснований происходят почти мгновенно. В раст-ворах этих веществ уже имеются активные частицы - противоположно заряженные ионы. Поэтому реакции между водными растворами кислот, солей и оснований протекают очень быстро и существенно отличаются от реакций между этими же веществами, но взятыми в сухом виде.
Начиная урок на тему "Скорость химической реакции", учитель напоминает, что химические реакции могут идти с разной скоростью, изучение условий, которые влияют на нее, имеет большое практическое значение.
Как же можно измерить скорость химической реакции?
Учащиеся уже знают, что о скорости химического превращения можно судить по количеству вещества, вступившего в реакцию или получившегося за определенное время, что скорость механического движения измеряется путем, которое тело проходит в единицу времени; для вычисления этой скорости пользуются формулой
v=S/t
где v - скорость, S - путь и t - время.
С учетом этого учащиеся записывают по аналогии формулу для вычисления скорости химической реакции
v=m/t
где m - количество вещества, вступившего в реакцию или полученного в ее результате за время t.
Рассматривают, в чем недостаток этой формулы. Оказывается, что при ее использовании вычисляемая скорость реакции будет различной даже у двух порций одного и того же вещества, взятых в одинаковых условиях.
Предположим, что в сосуде в каждую секунду разлагается 15 г вещества. Выходит, что при введении в этот сосуд перегородки, которая разделит находящееся в нем вещество на две части в отношении 1 :2, в первой (меньшей) части реакция пойдет со скоростью 5 г/сек , а во второй - 10 г/сек.
Чтобы вычисляемая скорость характеризовала саму реакцию, а не то, какое количество исходного вещества взято, нужно учитывать изменение массы реагирующего вещества, отнесенное к объему, т. е. изменение концентрации, реагирующего вещества. Следовательно, скорость химической реакции можно вычислить по-формуле:
v=c0-ct/t
где c0 - первоначальная концентрация какого-нибудь из реагирующих веществ, ct - концентрация этого же вещества спустя t секунд. При вычислении скорости концентрацию обычно выражают в молях на литр, а время в секундах.
На данном уроке обращают внимание на важнейшие способы ускорения химических реакций. С этой целью проводят лабораторный опыт, показывающий, что скорость химической реакции зависит от концентрации реагирующих веществ.
Для опыта используют следующее оборудование, вы-ставленное на ученические столы: 1) штатив с тремя пробирками, в одной из которых находится кристаллик йодистого натрия или йодистого калия (величиной в 2 - 3 булавочных головки), в другой - раствор хлорного железа, а третья - пустая; 2) колба или стакан с водой; 3) две одинаковые стеклянные трубки; 4) стеклянная палочка.
Учитель предлагает учащимся провести подготовку к опыту: 1) прилить к йодистому натрию воды, чтобы образовалось 1/2 пробирки раствора, и перемешать жид-кость палочкой, 2) отлить 1/3 полученного раствора в другую пробирку, 3) добавить к отлитому в другую пробирку раствору воды, чтобы объемы растворов йодистого натрия (или йодистого калия) в пробирках были одинаковыми.
Учитель задает вопросы, чтобы проверить, как учащиеся понимают указания:
1) Во сколько раз разбавлен во второй пробирке раствор йодистого натрия?
2) Во сколько раз концентрация соли в первой про-бирке больше, чем во второй?
Отмечают, что концентрация одного из растворов вдвое больше концентрации другого. После этого в двух приготовленных растворах проводят реакцию хлорного железа с йодистым натрием, которая идет с выделением свободного йода:
2NaI + 2FeCl3 = 2NaCl + 2FeCl2 + I2,
2I- + 2Fe3+ = 2Fe2+ + I2.
Учащиеся решают, в какой пробирке скорость взаимодействия солей больше и по какому признаку об этом можно судить. Предположение проверяют на опыте.
В обе пробирки с растворами йодистого натрия (или йодистого калия) приливают сначала одинаковые количества крахмального клейстера (1-2 мл), а затем, после перемешивания, по нескольку капель 5-10-процентного раствора хлорного железа. Раствор хлорного железа желательно прилить в обе пробирки одновременно. Синяя окраска появляется скорее в пробирке с раствором большей концентрации. В той пробирке, где концентрация раствора больше, ионы йода чаще встречаются с ионами трехвалентного железа, а поэтому чаще вступают с ними во взаимодействие - реакция протекает быстрее.
Учитель показывает горение серы в воздухе и задает учащимся вопрос, как можно ускорить эту реакцию. Учащиеся предлагают поместить горящую серу в кислород и выполняют этот опыт. На основании анализа опытов делают общий вывод: скорость химической реакции зависит от концентрации реагирующих веществ (от количества ионов или молекул в единице объема).
Переходят к вопросу о влиянии на скорость химической реакции поверхности реагирующих веществ. Учащиеся вспоминают реакции с перемешиванием и измельчением реагирующих веществ: растирание смеси нашатыря с гашеной известью, взаимодействие мелких кусочков мрамора или цинка с соляной кислотой, сжигание пылевидного топлива в форсунках, использование измельченных руд при выплавке металлов и серного колчедана при получении серной кислоты. Более подробно рассматриваются условия обжига колчедана в производстве серной кислоты. Для получения сернистого газа применяют измельченный колчедан, так как он горит быстрее, чем колчедан, взятый в крупных кусках. Особенно быстро идет сгорание пылевидного колчедана, если его выбрасывают с током воздуха из форсунки, а также при его сжигании в кипящем слое, когда вся поверхность кусков колчедана соприкасается с воздухом.
Необходимо учитывать, что химические реакции с сильно измельченными горючими веществами могут сопровождаться взрывом. Бывали, например, взрывы сахарной пыли на заводах, вырабатывающих сахар.
Делают вывод, что чем сильнее измельчено твердое вещество, тем больше скорость химической реакции, в которой оно участвует.
Затем разбирают влияние температуры на скорость химической реакции. В пробирку с 1/4 раствора гипосульфита приливают такое же количество раствора серной кислоты; параллельно с этим опытом сливают нагретые растворы гипосульфита и серной кислоты:
Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2 + S↓
Отмечают время до помутнения растворов. Учитель говорит, что при повышении температуры на 10° С скорость большинства реакций увеличивается в 2-3 раза.
На основе приобретенных знаний учащимся предоставляют возможность самим объяснить ускорение химических реакций при нагревании веществ.
На этом уроке нет необходимости демонстрировать опыт каталитического воздействия веществ, так как учащиеся знакомились с ним на примерах реакции разложения перекиси водорода и окисления сернистого газа. Они перечисляют известные им каталитические реакции, приводят определения катализа и катализатора.
Для закрепления знаний на данном уроке предлагают вопросы:
- От чего зависит скорость химической реакции? Приведите примеры.
- При каких условиях скорость химической реакции возрастает?
- Как в свете теории электролитической диссоциации можно объяснить, что выделение водорода при взаимодействии цинка с уксусной кислотой происходит значительно медленнее, чем при взаимодействии цинка с соляной кислотой?
- Какими способами можно ускорить реакцию взаимодействия цинка с соляной кислотой?
- Почему тлеющая на воздухе лучинка вспыхивает в кислороде?
- Вам выданы две пробирки, в которых медленно идет взаимодействие углекислого кальция с соляной кислотой. Постарайтесь ускорить химическую реакцию в каждой из пробирок, используя разные приемы.
- Почему скорость химической реакции увеличивается с повышением температуры?
- Какие способы ускорения химических реакций применяют в производстве серной кислоты?
- Перечислить, какие известные вам химические реакции ускоряются с помощью катализаторов.
При изучении реакции синтеза аммиака учащиеся снова встречаются с применением катализатора, причем, наряду с закреплением ранее полученных сведений о катализе и катализаторе, можно эти знания несколько развить.
Учитель обращает внимание на то, что обе реакции - синтез аммиака и его разложение на азот и водород-идут в присутствии одного и того же катализатора - восстановленного железа, ускоряющего в одинаковой степени как прямую, так и обратную реакцию. Поэтому катализатор не смещает химического равновесия, а лишь способствует более скорому достижению этого состояния. Чтобы проверить понимание этого положения, учитель задает им вопросы:
- Можно ли на производстве получать аммиак из смеси азота и водорода под высоким давлением и при нагревании, но без катализатора? Почему?
- Реакцию синтеза аммиака ускоряют нагревание и катализатор. В чем различие влияния этих условий на химическое равновесие?
Знакомя учащихся с синтезом аммиака на производстве, учитель указывает, что катализатор быстро теряет свою активность, если газы (водород и азот) не будут предварительно освобождены от примесей. В данном процессе отравляющее действие оказывают кислород, водяной пар, окись углерода, сероводород и другие сернистые соединения.
Как и в случае каталитического окисления двуокиси серы в трехокись, при синтезе аммиака катализатор оказывает свое ускоряющее действие лишь в некоторых температурных пределах. При температуре выше 600° С восстановленное железо снижает свою каталитическую активность.
На примере синтеза аммиака можно рассмотреть механизм действия катализатора. Отмечают, что на поверхности железного катализатора образуется нитрид железа:
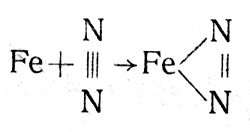
Водород реагирует с нитридом, получается аммиак:
FeN2 + 3H2 → Fe + 2NH3.
Затем процесс повторяется.
Реакции образования нитрида железа и его взаимодействия с водородом идут очень быстро.
При изучении реакций окисления аммиака, после демонстрации опытов горения аммиака в кислороде и каталитического окисления аммиака, внимание учащихся обращают на то, что исходные вещества в двух этих случаях были взяты одни и те же, но в зависимости от условий (применение катализатора) получаются разные продукты.
Окисление аммиака может идти с образованием разных веществ по уравнениям:
4NH3 + 3O2 = 2N2 + 6H2O;
4NH3 + 4O2 = 2N2O + 6H2O;
4NH3 + 5O2 = 4NO + 6H2O.
Катализатор - платина ускоряет лишь последнюю из этих реакций. Поэтому, используя катализатор, можно направить взаимодействие аммиака и кислорода в желательную сторону. Это находит применение в химическом производстве при получении азотной кислоты.
Формирование в IX классе понятия о химическом производстве представляет большие возможности для ознакомления учащихся с практическим управлением скоростью химических реакций на химических заводах.
На основе обобщения знаний об изученных ранее производствах (соляной, серной, азотной кислот, аммиака) учитель формирует у учащихся понятие о наилучших условиях проведения химических реакций на производстве: применении оптимальных температур, повышении концентрации реагирующих веществ, увеличении поверхности соприкосновения реагирующих веществ, использовании катализаторов. После этого, чтобы выявить обстоятельства, ограничивающие применение каждого условия, перед учащимися ставится вопрос: "Можно ли для ускорения химических реакций на производстве неограниченно повышать температуру?" Выясняют, что сильное нагревание может сместить химическое равновесие в нежелательную сторону, а в случае применения катализатора снизить его активность. Учитывая это, на производстве применяют не максимальные, а оптимальные температуры.
В таком же плане разбирают и другие условия проведения химических реакций на производстве.
Изучение нового фактического материала по химии в IX-X классах используют для дальнейшего закрепления знаний о скорости химической реакции.
При изучении свойств белого фосфора учитель говорит, что свечение белого фосфора в темноте свидетельствует о медленном окислении его на воздухе. Далее рассматривают, при каких условиях окисление белого фосфора может быть ускорено. Нагревание, раздробление фосфора, применение кислорода действительно ускоряют окисление фосфора, вызывая его вспышку.
Знания о способах ускорения химических процессов учащиеся применяют для предсказания условий образования суперфосфата. Они говорят, что реакция между третичным фосфатом кальция и серной кислотой может ускоряться при нагревании, измельчении фосфата кальция, перемешивании, увеличении концентрации серной кислоты. Учитель, обобщая сказанное, добавляет, что в
данном производстве нагревание действительно применяют, но для этого используют теплоту, выделяющуюся при самой реакции, когда измельченный третичный фосфат кальция тщательно перемешивают с серной кислотой.
По мере изучения органических веществ учащиеся встречаются с очень многими процессами, которые при-водят с участием катализаторов, например получение авиационного бензина, каучука, ароматических углеводородов.
Можно рассмотреть роль серной кислоты при гидратации этилена. В присутствии серной кислоты вместо медленно идущей реакции присоединения воды к этилену (С2Н4 + Н2О → С2Н5ОН) быстро идут один за другим следующие процессы: 1) серная кислота присоединяется к этилену, образуя серноэтиловый эфир:
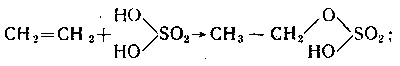
2) серноэтиловый эфир подвергается омылению с образованием этилового спирта и серной кислоты.
После отгонки спирта серная кислота оказывается в том же количестве, но она принимала участие в образовании промежуточного продукта. Другие примеры каталитического действия серной кислоты (образование этилена и этилового эфира из этилового спирта) учащиеся разбирают самостоятельно при выполнении домашнего задания.
Одни и те же вещества при одном и том же катализаторе, но при разной температуре реагируют с образованием различных продуктов. Это следует подчеркнуть при ознакомлении со свойствами спиртов.
Взаимодействие окиси углерода с водородом показывает, что, применяя различные катализаторы, из одних и тех же веществ можно получить разные органические продукты. Это взаимодействие может идти с образованием метилового спирта, углеводородов или высших спиртов. Желательное направление взаимодействия веществ достигается благодаря применению такого катализатора, который ускоряет соответствующую реакцию, но не оказывает значительного влияния на другие. Чтобы ускорить реакцию образования метилового спирта, в качестве катализатора применяют смесь окислов хрома с окисью цинка.
После изучения углеводородов и кислородсодержащих органических соединений для обобщения знаний учащимся предлагают задание для самостоятельной работы на уроке или дома: выбрать из такого-то раздела учебника все случаи каталитических реакций, причем каждому учащемуся дают лишь такую часть материала учебника, которую он может просмотреть в отведенное время.
Разбирая промышленные способы получения органических веществ, полезно обратить внимание учащихся на то, что для управления скоростями химических реакций применяют те же приемы которые используют в производстве неорганических
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'