
5. Обратимость химических реакций и химическое равновесие
Понятия об обратимости реакций и химическом равновесии относятся к трудно-усваиваемым. Наблюдения на уроках и экспериментальная работа в школах показывают, что существует целый ряд условий, при которых рассматриваемые понятия развиваются наиболее правильно и успешно*.
* (Методика и результаты этого исследования рассмотрены подробно в брошюре Т. 3. Савич "Методика развития знаний учащихся об обратимости химических реакций и химическом равновесии" (М.-, Изд-во АПН РСФСР, 1961).)
При развитии знаний об обратимости химических ре-акций и химическом равновесии следует использовать уже знакомые учащимся реакции, изучаемые при разборе фактического материала химии. Привлечение в качестве примеров малознакомых химических процессов отвлекает внимание от того, что в данном случае требуется рассмотреть. Важно установить связь понятия о химическом равновесии со знаниями о скорости химической реакции и строением вещества.
Формирование понятий об обратимости химических реакций начинается в теме "Кислород и сера". Учитывая, что, изучая химию, учащиеся уже встречались с обратными друг другу превращениями, учитель на доске записывает уравнения и условия нескольких таких реакций:

После записи уравнений отмечают, что эти противоположно направленные реакции проводились при разных условиях. Но обратные процессы могут идти в одной и той же смеси веществ и при одинаковых условиях. С подобными явлениями учащиеся встречались при изучении растворения веществ и диссоциации кислот, оснований, солей в воде. Эти процессы называются обратимыми и могут быть записаны с помощью двух противоположно направленных стрелок:
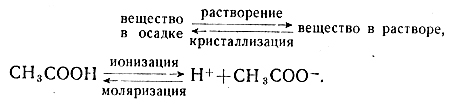
Затем ставится вопрос, не будут ли обратимыми и те химические реакции, которые идут не в РОДНОМ растворе, а в других условиях. Для его решения проводят опыт, который позволяет установить, что взаимодействие серы с водородом относится к обратимым реакциям. Чтобы провести такой опыт, используют прибор, в котором горизонтально расположенная стеклянная трубка с шариком посредине соединена с одной стороны с аппаратом Киппа, а с другой - со стеклянной газоотводной трубкой, согнутой под прямым углом. В шарик трубки помещают серу. После пропускания через прибор водорода и испытания его на чистоту серу нагревают, а образование сероводорода обнаруживают раствором уксуснокислого свинца или влажной фильтровальной бумагой, пропитанной этим раствором.
Когда доказано, что сера реагирует с водородом с образованием сероводорода и записано уравнение:
H2 + S = H2S,
газоотводную трубку в одном месте сильно нагревают и здесь на ее стенках выделяется сера. Это указывает на то, что при более сильном нагревании сероводород разлагается:
H2S = H2 + S.
После проведения опыта перед учащимися ставят вопрос: "Не может ли при более сильном нагревании наряду с разложением сероводорода идти его образование?" Для решения вопроса сначала совсем прекращают нагревать трубку, продолжая пропускать через нее водород, а затем шарик трубки с оставшейся там серой нагревают так же интенсивно, как до этого нагревали газоотводную трубку. И в этом случае раствором уксуснокислого свинца или влажной фильтровальной бумагой, пропитанной этим раствором, устанавливают образование сероводорода.
Проведенные опыты показывают, что при высокой температуре идет не только разложение сероводорода, но и его образование. Два противоположно направленных процесса, идущих в одинаковых условиях, записывают с помощью общего уравнения:
H2 + S ↔ H2S .
Дают определение: "Обратимой называется химическая реакция, протекающая при одинаковых условиях одновременно в двух противоположных направлениях (прямом и обратном)".
Учитель приводит несколько примеров обратимых химических реакций (взаимодействия хлористого натрия с сернокислой медью, хлористого натрия с серной кислотой, водорода с йодом) и предлагает указать в каждом случае прямую и обратную реакцию.
После этого полезно рассмотреть вопрос о том, как практически обнаружить, обратима ли та или иная химическая реакция или нет.
Учащимся предлагают решить этот вопрос, а затем учитель при подведении итогов отмечает наиболее важное. Он указывает, что при обратимой реакции полного
превращения исходных веществ в продукты реакции не происходит. При необратимой реакции, т. е. реакции, идущей до конца, можно осуществить полное превращение исходных веществ в продукты реакции.
В дальнейшем учащиеся закрепляют полученные знания об обратимости химической реакции при изучении других химических превращений и прежде всего на примере образования сернистой кислоты при растворении сернистого газа в воде.
Сернистый газ пропускают некоторое время через воду, а затем к полученному раствору прибавляют раствор лакмуса. Изменение цвета индикатора показывает, что двуокись серы, реагируя с водой, образует кислоту. Записывают уравнение реакции:
H2O + SO2 = H2SO3.
Затем учащиеся убеждаются, что раствор сернистой кислоты пахнет сернистым газом. Выясняют, чем же можно объяснить наличие в растворе сернистого газа. В поисках ответа могут возникнуть следующие предположения: двуокись серы есть в растворе потому, что ее реакция с водой обратима, или двуокись серы из-за медленного течения реакции не успела еще полностью прореагировать с водой. Последнее предположение не может быть опровергнуто с помощью опыта, доступного в школьных условиях. Поэтому учитель ссылается на наблюдения, которые проводились в лаборатории. Если раствор сернистого газа держать длительное время в плотно закрытом сосуде, то в этом растворе с сернистой кислотой всегда будет находиться двуокись серы. Это указывает на то, что реакция между двуокисью серы и водой обратима. В написанном уравнении ставят знак обратимости.
Учащиеся отмечают, какая реакция в данном случае будет прямой, а какая - обратной, какие вещества находятся в водном растворе сернистого газа.
Изучают обратимую реакцию окисления двуокиси серы в трехокись. Получение серного ангидрида проводят в приборе, изображенном на рисунке 2.
Чтобы рассмотреть вопрос об обратимости реакции окисления сернистого газа в серный ангидрид, нужно прежде всего доказать, что не весь сернистый газ даже при наличии избытка кислорода превратился в серный ангидрид. Сернистый газ и серный ангидрид выходят из катализаторной трубки и собираются в U-образной трубке. Остатки их поступают в промывную склянку и поглощаются раствором едкого натра. Для обнаружения сернистого газа, не превратившегося в" серный ангидрид, часть раствора из промывной склянки отливают в колбу и прибавляют к нему столько раствора хлористого бария, чтобы полностью осадить сернокислый барий и сернистокислый барий. Осадок отфильтровывают и к нему приливают соляную кислоту. Происходит частичное растворение осадка и образование сернистого газа.
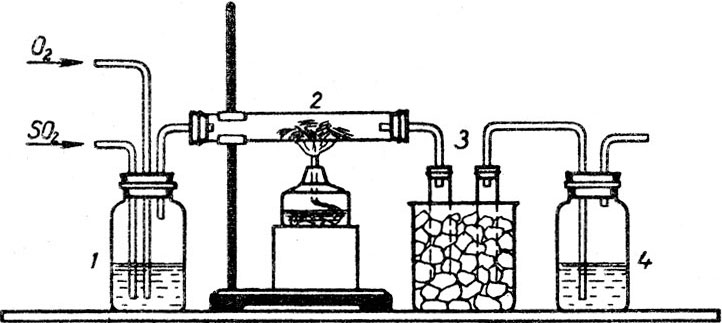
Рис. 2. Прибор для окисления сернистого газа в серный ангидрид: 1 - концентрированная серная кислота; 2 - катализатор; 3 -U-образная трубка; 4 - раствор едкого натра
Учитель предлагает учащимся записать уравнения реакций, которые служили для доказательства, что сернистый газ не полностью окислился в серный ангидрид. А затем сообщает, что смесь сернистого ангидрида и кислорода не могла бы полностью превратиться в серный ангидрид даже при очень длительном нагревании в присутствии катализатора, так как реакция между сернистым газом и кислородом обратима.
Перед изучением производства серной кислоты необходимо указать, что при сильном нагревании. меньшая часть сернистого газа превращается в серный ангидрид, чем при более слабом. Однако в последнем случае реакция идет медленнее и это заставляет повышать температуру. Чтобы проводить реакцию при сравнительно невысоких температурах, но заставить ее идти с большей скоростью, применяют катализатор.
Чтобы приступить к формированию понятия о химическом равновесии на примере синтеза аммиака, необходимо предварительно восстановить в памяти учащихся то, что им известно об обратимости химических реакций. Это удобно сделать в начале изучения темы "Азот и фосфор", используя рассмотрение процессов, идущих при растворении аммиака в воде.
На уроке при изучении химических свойств аммиака, после сравнения свойств водного раствора аммиака и раствора едкого натра, демонстрируют опыт: в дистиллированную воду (200 мл) приливают несколько капель нашатырного спирта и 1-2 капли фенолфталеина.
На вопрос учителя, чем обусловлено появление малиновой окраски, учащиеся отвечают, что изменение окраски вызвано присутствием в растворе аммиака ионов гидроксила. На доске записывают уравнение химической реакции:
NH3 + H2O → NH+4 + ОН-.
Затем предлагается выяснить, идет ли данная реакция до конца, т. е. до полного превращения исходных веществ в продукты реакции, или она обратима. Легкий запах аммиака, который замечают у испытуемой жидкости, указывает на то, что в растворе есть молекулы аммиака, часть из которых переходит в воздух. Взаимодействие аммиака с водой - процесс обратимый, в уравнении реакции ставят знак обратимости:
NH3+H2O ↔ NH4+ + OH-.
А что произойдет, если нагреть водный раствор аммиака?
Половину окрашенного в малиновый цвет раствора отливают в другую такую же колбу (для контроля). Одну из колб подогревают.
После этого выясняют, в каком растворе аммиака - нагретом или холодном - находится больше ионов гидроксила и чем можно объяснить уменьшение количества этих ионов при нагревании раствора.
Обращают внимание учащихся на то, что уменьшение количества ионов гидроксила в растворе могло произойти в связи с улетучиванием аммиака при нагревании раствора. А из-за уменьшения количества аммиака снизилась скорость прямой реакции, ведущей к образованию ионов гидроксила. Скорость же обратной реакции некоторое время остается больше скорости прямой реакции.
Затем раствор охлаждают - его окраска почти восстанавливается. Это показывает, что хотя аммиак частично и улетучился из раствора, но все же осталась его достаточно, чтобы снова, реагируя с водой, давать ионы гидроксила.
Причина уменьшения количества ионов гидроксила в растворе при нагревании не только в улетучивании аммиака. Хотя нагревание всегда ускоряет как прямую, так и обратную реакцию, в рассматриваемом случае скорость обратной реакции увеличивается больше. Поэтому еще больше ускоряется взаимодействие ионов NH+4 и ОН-, а количество ионов ОН- в растворе уменьшается.
На примере реакции синтеза аммиака у учащихся формируется понятие о химическом равновесии. Поэтому очень важно сначала показать, что данная химическая реакция может идти в двух противоположных направлениях при одних и тех же условиях.
При демонстрации опытов получения аммиака в приборе, предложенном В. С. Полосиным (рис. 3), полезно использовать на уроке два прибора: один из них с трубкой без катализатора, а другой - с катализатором. Параллельная постановка опыта даст возможность убедиться, что только при наличии нагреваемого катализатора образуется аммиак:
N2 + 3H2 → 2NH3.
Появление аммиака доказывают с помощью раствора фенолфталеина.
После этого демонстрируют разложение аммиака (рис. 4), причем этот опыт лучше поставить так, как это рекомендует В. С. Полосин*.
* (В. С. Полосин. К методике изучения условий химического равновесия. "Химия в школе", 1958, № 1, стр. 32-34.)
Колбу с концентрированным водным раствором аммиака закрывают пробкой с тройником, концы которого присоединяют к двум трубкам с катализатором (восстановленное железо). Обе катализаторные трубки, одну из которых нагревают, а другую нет, соединены с газоотводными трубками. Выходящие газы собирают над водой. Поджиганием определяют водород, выходящий из нагреваемой трубки.
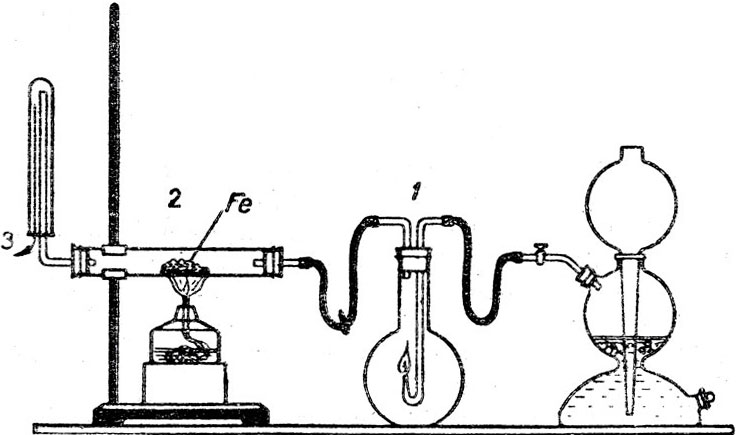
Рис. 3. Прибор для синтеза аммиака с использованием азота воздуха: 1 - колба (объем не менее 1 л); 2 - трубка с катализатором; 3 - влажная лакмусовая бумажка
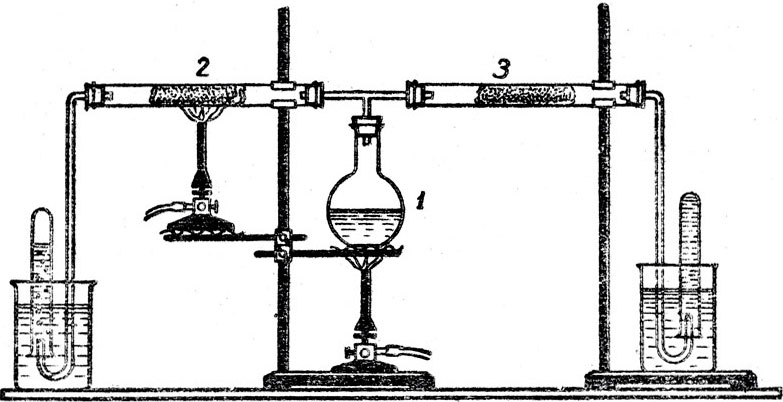
Рис. 4. Прибор для разложения аммиака: 1 - концентрированный водный раствор аммиака; 2, 3 - трубки с катализатором
Внимание учащихся обращается на то, что синтез и разложение аммиака идут при одинаковых условиях (катализатор - восстановленное железо, высокая температура). Уравнение синтеза аммиака нужно записать так:
N2 + 3H2 ↔ NH3.
Обратимость данной реакции можно обнаружить, если доказать, что часть исходных веществ не превратилась в продукты реакции. Чтобы на опыте доказать, что аммиак полностью не разложился, испытывают фенолфталеином ту воду, через которую проходил водород, поступающий из катализаторной трубки. Фенолфталеин окрашивается в малиновый цвет.
Чем объясняется, что обратимая реакция не доходит до конца?
Обратимая реакция не доходит до конца потому, что наряду с прямой, соединения азота и водорода, идет обратная реакция, разложения аммиака.
Подходя еще ближе к понятию о химическом равновесии, учащимся предлагают указать, какие химические реакции происходят в закрытой трубке с катализатором, в которую поместили смесь азота с водородом. Трубка нагрета до температуры, при которой азот и водород реагируют между собой. Молекулы азота и водорода взаимодействуют и получаются молекулы аммиака (прямая реакция). В то же время молекулы аммиака, разлагаясь, образуют молекулы азота и водорода (обратная реакция).
Как же с течением времени изменяются скорости прямой и обратной реакции?
Скорость прямой реакции постепенно уменьшается, так как уменьшается концентрация исходных веществ- азота и-водорода, скорость же обратной реакции растет, так как концентрация аммиака возрастает.
Подводя некоторые итоги, учитель указывает, что в начале взаимодействия веществ соотношение скоростей прямой и обратной реакции условно можно изобразить так:
N2 + 3H2 ←→→ 2NH3
(стрелки разной длины указывают на то, что прямая и обратная реакции идут в данный момент с разными скоростями). Однако с течением времени скорости прямой и обратной реакций уравниваются, это можно изобразить двумя противоположно направленными стрелками равной длины:
N2 + 3H2 ↔ 2NH3.
Такое состояние реагирующей смеси, когда скорость прямой реакции равна скорости обратной, называется химическим равновесием, или: "Химическим равновесием называется такое состояние реагирующей смеси, когда в единицу времени из исходных веществ образуется столько молекул новых, сколько их вновь превращается в исходные вещества".
Для проверки правильности понимания формулировок учитель задает несколько вопросов:
- Какие вещества находятся в реагирующей смеси, когда установилось химическое равновесие при синтезе аммиака?
- Происходят ли какие-нибудь изменения в реагирующей смеси в момент химического равновесия? В чем эти изменения заключаются?
- При химическом равновесии из азота и водорода в 1 сек образовалось n молекул аммиака: а) увеличилось ли при этом количество аммиака, находящееся в реагирующей смеси? б) Сколько молекул азота образовалось за это же время? в) Сколько молекул водорода образовалось за это же время? г) Сколько молекул водорода образуется в следующую секунду? д) Сколько молекул аммиака будет образовываться в каждую последующую секунду? е) Сколько молекул водорода будет вступать в реакцию в каждую последующую секунду?
На первый вопрос учащиеся должны ответить, что в реагирующей смеси находятся не только азот и водород, но и аммиак. Второй вопрос требует, чтобы они обратили внимание на то, что в момент химического равновесия с одинаковыми скоростями идут две противоположно направленные химические реакции. При химическом равновесии одни молекулы азота, водорода и аммиака распадаются, другие образуются. Это учитель разъясняет, используя понятие о меченых атомах. Если бы для реакции синтеза аммиака была использована смесь молекул азота, состоящих из обыкновенных атомов, и молекул азота, имеющих в своем составе меченые атомы, то можно было бы определить, что меченые атомы азота и при химическом равновесии все время переходят из молекул азота в молекулы аммиака. Соотношение между общим количеством меченых атомов азота, находящихся во всех молекулах азота, и общим количеством меченых атомов азота, содержащихся во всех молекулах аммиака, даже и в момент химического равновесия не оставалось бы постоянным: то меченые атомы азота переходили бы в большей степени в молекулы азота, то в молекулы аммиака.
На третий вопрос дают следующие ответы. На основании определения понятия о химическом равновесии можно сказать, что если в 1 сек образовалось n молекул аммиака, то сколько их за это же время разложилось. Из уравнения N2 + 3Н2 ↔ 2NH3 видно, что из n молекул аммиака при разложении получается n/2 молекул азота и 3n/2 молекул водорода. Например, из 1000 молекул аммиака может получиться 500 молекул азота и 1500 молекул водорода.
В следующую секунду повторится то же самое, так как скорость прямой и скорость обратной реакции по достижении химического равновесия изменяться не будет. Опять будет получаться и превращаться в другие вещества n молекул аммиака, n/2 молекул азота, 3n/2 молекул водорода.
После решения задачи следует отметить, что при химическом равновесии в составе реагирующей смеси аммиака может быть очень мало. Например, при 500° С и атмосферном давлении содержание аммиака в реагирующей смеси, находящейся в состоянии химического равновесия, составляет только 0,1%.
Возникает вопрос, как можно изменить содержание аммиака в реагирующей смеси. Отмечают, что без изменения условий (температуры, давления) это осуществить невозможно. Лишь при изменении температуры и давления скорости реакций образования аммиака и его разложения изменяются неодинаково. При увеличении давления, прямая реакция (образование аммиака) ускоряется больше, чем обратная (его разложение). Сначала это приводит к неравенству скоростей двух противоположно направленных процессов обратимой химической реакции, что можно отметить в уравнении, применив стрелки разной длины:
N2 + 3H2 ↔ 2NH3.
Затем скорости реакции выравниваются и снова возникает состояние химического равновесия, но состав реагирующей смеси уже оказывается другим, в ней уже содержится относительно больше аммиака. Ведь за время выравнивания скоростей аммиака больше образовывалось, чем разлагалось. Данные о влиянии давления учитель в виде таблицы записывает на доске.
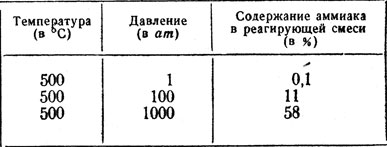
При повышении температуры обратная реакция (разложение аммиака) ускоряется больше, чем прямая (его образование). Учащимся предлагают решить, как это обстоятельство отразится на содержании аммиака в реагирующей смеси. При ответе на вопрос используют такие же примерно рассуждения, как и при рассмотрении влияния изменения давления на данное химическое равновесие. В результате учащиеся приходят к выводу, что с повышением температуры содержание аммиака в реагирующей смеси должно уменьшаться (на доске записывают таблицу):

На основании разобранного материала делают вывод: если изменить условия, при которых реагирующая' смесь находилась в состоянии химического равновесия,
то содержание в ней реагирующих веществ изменяется. Переход смеси реагирующих веществ в результате изменения условий из одного состояния равновесия в другое называется смещением химического равновесия.
Для закрепления материала учащимся предлагают вопросы и задания:
- В результате химических превращений образовалась смесь водорода, азота и аммиака, находящаяся в состоянии химического -равновесия. Как нужно изменить условия, в которых находится смесь, чтобы: а) увеличить в ней содержание аммиака, б) уменьшить содержание водорода, в) увеличить содержание азота?
- К равновесной смеси водорода, азота и аммиака добавили еще водорода. Произошло ли смещение химического равновесия? В какую сторону? Почему?
- Из равновесной смеси водорода, азота и аммиака удалили некоторое количество аммиака, а затем снова создали прежние условия. Произошло ли смещение химического равновесия? В какую сторону? Почему?
Необходимо подчеркнуть, что состояние химического равновесия возникает не только при синтезе аммиака, но и при любой другой обратимой реакции, если ни одно из веществ не может удалиться из сферы реакции, химическое равновесие может смещаться под влиянием тех или иных условий. Легче всего судить о том, как будет смещаться химическое равновесие под влиянием изменения концентраций реагирующих веществ, так как известно, что увеличение концентрации одного из реагирующих веществ способствует ускорению той реакции, в которой оно участвует как исходное.
Общие правила относительно смещения химических равновесий под влиянием изменений температуры и давления будут введены в дальнейшем.
До ознакомления с правилами учащиеся могут предсказывать влияние температуры и давления на смещение лишь некоторых химических равновесий. К ним относятся равновесия, возникающие в результате обратимых реакций, которые идут в растворах с участием растворенных газов или легко-летучих веществ, например:
NH3 + H2O ↔ NH4+ + ОН-.
Для выяснения влияния на эту реакцию изменений температуры необходимо учитывать, что с повышением температуры растворимость газов в воде уменьшается. Если нагревать раствор аммиака, то из него постепенно удаляется аммиак, прямая реакция в связи с этим замедляется, что вызывает смещение химического равновесия влево.
С увеличением давления растворимость газов в воде увеличивается. Если повысить давление в сосуде, где находится раствор аммиака, то находящиеся над этим раствором молекулы газа аммиака будут переходить в раствор, концентрация аммиака и скорость прямой реакции возрастут, что приведет к смещению химического равновесия вправо.
Такие же рассуждения можно применить к другим химическим равновесиям.
Знания о химическом равновесии закрепляют при изучении производства аммиака. Особенно обращают внимание на то, какое влияние на равновесие оказывают давление, температура, применение катализатора, отделение аммиака от реагирующей смеси.
Учащиеся должны различать влияние тех или иных условий на смещение химического равновесия и на более быстрое достижение самого состояния равновесия. Учитель объясняет, что, повышая температуру, смещают химическое равновесие при синтезе аммиака справа налево, т. е. в нежелательную сторону. Это происходит потому, что с нагреванием скорость обратной реакции растет больше, чем скорость прямой. Вместе с тем нельзя проводить синтез аммиака при низких температурах, так как в этом случае при небольших скоростях прямой и обратной реакций само состояние химического равновесия будет возникать лишь через очень значительное время. Поэтому обычно синтез аммиака в производственных установках проводят при 450-500° С.
Катализатор в одинаковой степени ускоряет прямую и обратную реакцию, а, следовательно, не может оказать какого-нибудь воздействия на его смещение. Вместе с тем катализатор, ускоряя реакции синтеза аммиака и его разложения, в значительной степени способствует более быстрому достижению состояния химического равновесия.
Выясняя роль циркуляции веществ в установке для синтеза аммиака, подчеркивают, что если реагирующую смесь без отделения аммиака пропустить вновь через колонну синтеза, то новой порции аммиака не получится. В этой смеси, находящейся в состоянии химического равновесия, аммиак с такой же скоростью образуется, с какой разлагается. При отделении аммиака с помощью холодильника и сепаратора снова появляются возможности при тех же условиях получить даже из той же смеси азота и водорода дополнительные количества аммиака.
При последующем изучении темы "Азот и фосфор" знания о химическом равновесии конкретизируются.
Смещение химического равновесия при изменении температуры и давления очень удобно показать на примере реакции полимеризации двуокиси азота в четырех-, окись.
При изучении окислов азота учащимся указывают, что молекулы двуокиси азота могут соединяться между собой, образуя вещество с формулой N2O4. Двуокись азота - бурый газ, а четырехокись азота - бесцветный. Поэтому признак превращения двуокиси азота в четырехокись-исчезновение бурой окраски.
Образование четырехокиси азота из двуокиси и обратное превращение происходит уже при комнатной температуре:
2NO2 ↔ N2O4.
Учащимся демонстрируют колбу, наполненную предварительно двуокисью азота и закрытую пробкой. Учитель спрашивает, какие вещества имеются в колбе. Учащиеся отвечают, что в колбе имеется смесь двух газов: двуокиси и четырехокиси азота.
Выясняют, будет ли изменяться состав реагирующей смеси, находящейся в колбе, если не изменять условий? Почему состав газовой смеси не меняется, если в ней идут химические реакции? При разборе этих вопросов учащиеся учитывают, что смесь находится в закрытом сосуде при постоянных условиях. В ней за счет течения обратимой реакции возникло состояние химического равновесия. Поэтому за единицу времени, например за 1 сек, столько же молекул двуокиси азота превращается в четырехокись азота, сколько их образуется из этой четырехокиси.
Учитель говорит, что на примере реакции превращения двуокиси азота в четырехокись можно хорошо наблюдать смещение химического равновесия под влиянием изменений температуры. Он предлагает посмотреть те опыты, которые будут демонстрировать, и дать объяснения.
Две одинаковые бутылки для молока (емкостью в 0,5 л) наполняют двуокисью азота. Для равномерного наполнения газами одну бутылку опрокидывают над другой и их содержимое хорошо перемешивают. Одну бутылку закрывают пробкой, она служит контрольной. Вторую бутылку закрывают пробкой с пропущенными через нее толстыми железными или медными проволоками, соединенными между собой внутри бутылки куском спирали от электроплитки. Проволоки и кусок спирали должны быть расположены так, чтобы при их нагревании не происходило сильного накаливания стенок бутылки. Когда приборы собраны, внимание учащихся обращается на то, что в обеих бутылках окраска газов одинаковая. Затем к внешним концам железных или медных проволок присоединяют электропровода с включенным последовательно в цепь реостатом. Включив цепь в электросеть, изменяют реостатом силу тока так, чтобы спираль в бутылке с газами нагрелась. Смесь газов нагревается и буреет. При включении тока смесь газов постепенно охлаждается и приобретает первоначальную окраску.
Можно также, несколько видоизменив предыдущий опыт, показать с помощью двух бутылок, наполненных смесью двуокиси и четырехокиси азота, влияние на эту смесь не нагревания, а охлаждения. В этом случае две бутылки также наполняют двуокисью азота и обе закрывают пробками. Одну из бутылок помещают в охлаждающую смесь (снега с солью), а другую оставляют на столе (при комнатной температуре). Газовая смесь в одной из бутылок охлаждается и обесцвечивается.
После проведения опытов учащимся можно предположить следующие вопросы:
- Почему при нагревании смеси газов произошло побурение, а при охлаждении - обесцвечивание?
- В какую сторону смещается химическое равновесие в случае данной реакции при нагревании и охлаждении газовой смеси?
- Какая реакция, прямая или обратная, при нагревании ускоряется больше?
- Какая реакция, прямая или обратная, при охлаждении замедляется?
При изучении производства азотной кислоты обращают внимание на то, что реакция, происходящая при растворении двуокиси азота в воде (3NO2 + H2O ↔ 2HNO3 + NO), обратима. Чтобы развивать у учащихся умение представлять, в какую сторону будет смещаться химическое равновесие при изменении концентрации тех или иных реагирующих веществ, а также и для того, чтобы помочь им понять значение добавления к реагирующей смеси кислорода, ставят вопросы:
- Какие вещества находятся в данной реагирующей смеси при химическом равновесии?
- Какое влияние на смещение этого химического равновесия окажет прибавление к реагирующей смеси двуокиси азота?
- Какое влияние на смещение химического равновесия окажет удаление из реагирующей смеси окиси азота?
Отвечая на поставленные вопросы, учащиеся указывают, что добавление к реагирующей смеси двуокиси азота ускоряет прямую реакцию и тем самым смещает положение химического равновесия слева направо. В том же направлении действует и удаление из реагирующей смеси окиси азота, что замедляет обратную реакцию. Удаление из реагирующей смеси окиси азота и увеличение количества в ней двуокиси азота успешно достигается прибавлением кислорода: (2NO + O2 = 2NO2).
При дальнейшем изучении темы "Азот и фосфор" в в порядке упражнений решают задачи:
- В каком направлении сместится химическое равновесие (NH3 + H2O ↔ NH4+ + OH-) В водном растворе аммиака, если добавить к этому раствору едкого натра?
- Что произойдет с химическим равновесием (NH3 + H2O ↔ NH4+ + OH-) в водном растворе аммиака, если добавить к раствору немного соляной кислоты?
- Какие условия используют в производстве аммиака для смещения химического равновесия в желательном направлении? Какие условия в этом же производстве способствуют более быстрому достижению состояния химического равновесия?
- Что произойдет с химическим равновесием при ре-акции синтеза аммиака, если к реагирующей смеси добавить аммиак?
- В каком направлении сместится химическое равновесие при реакции окисления сернистого газа в серный ангидрид, если повысить температуру смеси? (Следует учесть, что с повышением температуры скорость обратной реакции в данном случае увеличивается больше, чем скорость прямой.)
Примеры обратимых реакций, на которых можно закреплять у учащихся знания об обратимости химических реакций и химическом равновесии, продолжают встречаться и в последующем материале курса химии. В теме "Углерод и кремний" рассматривают, например, реакцию, происходящую при взаимодействии углекислого газа с водой. Учитель отмечает, что эта реакция обратима, и, записав ее уравнение на доске (Н2O + СO2 ↔ Н2СO3), предлагает учащимся решить, какие условия будут способствовать в этом случае смещению химического равновесия слева направо, т. е. в сторону образования относительно больших количеств угольной кислоты.
После изучения неорганических веществ очень важно, подытожив то, что известно о смещении химических равновесий при изменениях температуры и давления, свести это к общим правилам относительно направлений такого смещения.
Учащимся предлагают вспомнить пример обратимых химических реакций* и выписать их уравнения на доске. Когда примеры подобраны, на доске отмечают, в какую сторону смещается каждое равновесие при повышении температуры и увеличении давления. Это может быть сделано в виде таблицы.
* (Задание по подбору примеров может быть дано учащимся на дом.)
После заполнения таблицы определяют, нет ли какой-либо закономерности между смещением химического равновесия при повышении температуры и экзотермичностью или эндотермичностыо данной реакции.
Приходят к выводу, что химические реакции, идущие в прямом направлении с выделением теплоты, при повышении температуры смещаются в сторону обратной реакции, а идущие с поглощением теплоты - в сторону прямой.

Так как учащиеся знакомы с тем, какой объем занимает каждая грамм-молекула любого газа при нормальных условиях, а также и с тем, что при изменении условий объемы разных газов изменяются почти одинаково, то можно объяснить им три разных случая влияния давления на химическое равновесие.
Если в результате прямой реакции количество молекул газообразных веществ уменьшается (первый случай), то при постоянном давлении уменьшается и объем реагирующей смеси. Наоборот, увеличение давления на реагирующую смесь ведет к уменьшению ее объема, а следовательно, способствует течению прямой реакции. Увеличение давления будет способствовать смещению равновесия в обратном направлении, если в результате прямой реакции количество молекул газообразных веществ, а следовательно, и объем смеси увеличивается (второй случай). Наконец, когда в результате реакции не происходит изменения объема реагирующей смеси, то и давление не оказывает на смещение равновесия никакого влияния.
Общий вывод очень прост: увеличение давления смешает химическое равновесие, если в результате реакции изменяется объем реагирующей смеси, и в сторону тех веществ, образование которых ведет к уменьшению объема. Знания об обратимости химических реакций и химическом равновесии закрепляются при изучении органических веществ.
В теме "Кислородсодержащие органические соединения" знакомят учащихся с обратимостью реакции этерификации. Сначала проводят лабораторный опыт получения уксусноэтилового эфира*. В пробирку наливают 0,5 мл концентрированной уксусной кислоты (эссенции) и равный объем этилового спирта. Запах эфира не обнаруживают даже при подогревании смеси. После этого в пробирку приливают 0,5-1 мл концентрированной серной кислоты. Появляется запах эфира, усиливающийся при дальнейшем нагревании. Опыт показывает, что для течения реакции этерификации необходимо присутствие катализатора (серной кислоты) и нагревания.
* (Опыт описан в кн.: Л. А. Цветков. Эксперимент по органической химии в средней школе. М., "Просвещение", 1966. )
Обратимость реакции этерификации устанавливают так. В три пробирки наливают по нескольку капель уксусноэтилового эфира. В одну пробирку приливают воду в таком количестве; чтобы эфир только растворился в ней, в другую пробирку - раствор щелочи, в третью - раствор кислоты. Пробирки нагревают в стакане с горячей водой. В пробирке со щелочью запах эфира быстро исчезает, в пробирке с кислотой он ослабевает, а в пробирке с водой остается без изменений.
При анализе результатов опыта отмечают, что уксусноэтиловый эфир в тех же условиях, при которых проводилось его получение, вступает в реакцию с водой и образует уксусную кислоту и этиловый спирт. Следовательно, реакция этирификации обратима. Ее уравнение можно записать:
СН3СООН + С2Н5ОН ↔ СН3СООС2Н5 + Н2О.
Далее учащимся предлагают вопрос, почему в той пробирке, куда прилили раствор щелочи, запах эфира совсем исчез. Это зависит от полного омыления эфира в присутствии щелочи, которая нейтрализует выделяющуюся при омылении эфира уксусную кислоту и тем самым способствует течению реакции омыления до конца.
После проведения опытов с уксусноэтиловым эфиром подчеркивают, что состояние химического равновесия и его смещение можно наблюдать при обратимых реакциях не только неорганических, но и органических веществ.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'