
Гидриды лантана, неодима, иттрия и скандия (М.Е. Кост, В.И. Михеева)
Первые сообщения о синтезе водородных соединений лантана и неодима относятся к концу прошлого века [1-3]. По данным различных авторов, максимальное содержание водорода в них соответствует LaH3 [4] и NdH3 [5]. Для этих гидридов изучены кристаллическая структура [6], теплота образования, упругость диссоциации [7]. Соответственно этим исследованиям было высказано предположение, что дигидриды лантана и неодима представляют собой химические соединения постоянного состава. Дальнейшее же поглощение водорода приводит к образованию твердого раствора водорода в дигидриде [7].
Первое сообщение о гидриде скандия появилось лишь в 1960 г. [8]. В нем имеются данные о составе (ScH2) и кристаллической структуре этого соединения.
Гидрид иттрия описан [9, 10], однако индивидуального соединения получено не было. Предполагаемый состав гидридов: Y2H3 [9] и YH2,7 [10].
Гидриды рзэ в настоящем исследовании были получены непосредственным взаимодействием металла (образец 98-99%-ной чистоты содержал в качестве основных примесей другие рзэ) с водородом.
Последний получали термическим разложением гидрида титана. Металлы после предварительной тщательной очистки их поверхности гидрировали в вакуумной установке [11]. За ходом реакции следили по изменению давления водорода в системе.
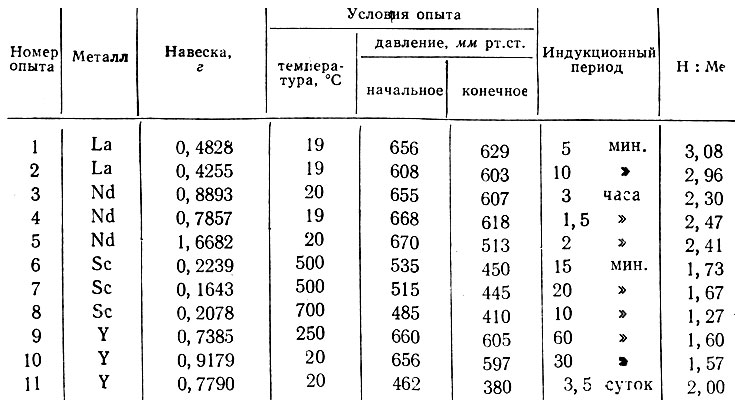
Результаты гидрирования металлов
* (Предварительная термическая обработка в вакууме при 400° С продолжалась 30 мин. )
В случае лантана и неодима реакция начинается при комнатной температуре. В отличие от предыдущей работы [12], в которой применяли электролитический водород, использование чистейшего водорода дало возможность получить гидрид иттрия с максимальным содержанием водорода также при комнатной температуре. Однако эта реакция имеет очень большой индукционный период (см. таблицу, опыт 11). Скандий гидрируется лишь при нагревании.
В результате реакции получаются серо-черные хрупкие гидриды, легко растирающиеся в порошок. Содержание водорода в них определяли волюмометрическим методом путем измерения количества водорода, выделяющегося при растворении в разбавленной НСl [11].
Максимальное достигнутое нами насыщение исследуемых металлов водородом соответствует формулам LaH3, NdH2,4, ScHi1,7, YH2.
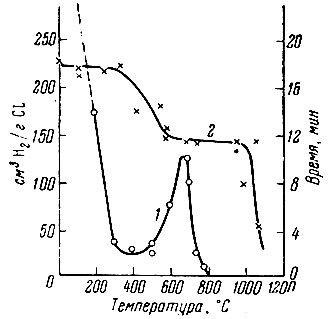
Рис. 1. Зависимость времени гидрирования (1) и состава гидрида лантана (2) от температуры
Для лантана было проведено исследование реакции гидрирования при различных температурах. Аналогично церию [11], кривая зависимости времени гидрирования (рис. 1) имеет две опускающиеся и одну подымающуюся ветвь, что может служить указанием на различный характер соединений, получающихся в соответствующих интервалах температур. Последующее изучение термической устойчивости полученных гидридов лантана показало, что, действительно, в области 0-300° С существует LaH3, в интервале 600-1000° С - LaH2, а при 300-600° С образуется твердый раствор водорода в дигидриде лантана.
По химическим свойствам гидриды рзэ существенно отличаются друг от друга. В то время как гидрид церия самовоспламеняется на воздухе, гидрид скандия практически не взаимодействует с водой и даже разбавленными кислотами. На примере Се, La и Nd было показано, что химическая активность, в частности скорость гидролиза, резко падает с уменьшением содержания кислорода.
При изучении термической устойчивости выяснилось, что гидриды лантана и неодима, аналогично гидриду церия, разлагаются в две стадии (рис. 2, 3). В интервале 200-600° С выделяется водород, избыточный над дигидридом, и лишь около 1000° С происходит разложение дигидрида на составляющие элементы. Аналогично ведет себя гидрид скандия (рис. 4). Ввиду небольшого содержания водорода для него характерна только вторая стадия разложения на элементы.
Несколько иначе выглядит термограмма разложения гидрида иттрия YН2 (рис. 5): около 400° С наблюдается отчетливый эндотермический эффект, соответствующий выделению половины водорода; далее выделение газа прекращается; лишь при 1000-1300° С начинается разложение оставшегося моногидрида.
Из приведенных данных видно, что отдельные рзэ существенно отличаются по своей абсорбционной способности и условиям [реакции гидрирования. Последнее вместе с различной термической стойкостью полученных гидридов открывает возможности применения их при достижении высокого вакуума, изготовлении пенометаллов и т. д. Кроме того, высокая реакционная способность этих гидридов может быть использована в различных областях неорганического синтеза.
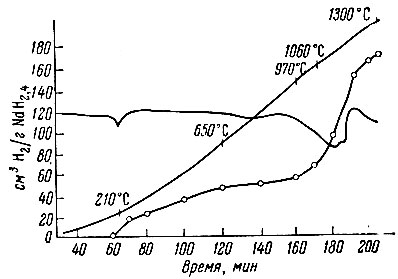
Рис. 2. Термограмма разложения NdH2,4
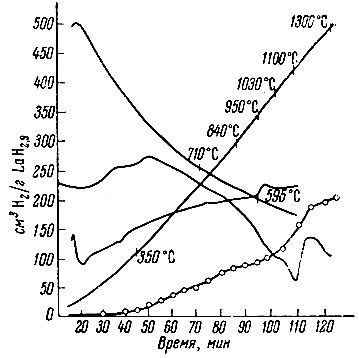
Рис 3. Термограмма разложения LaH2,9
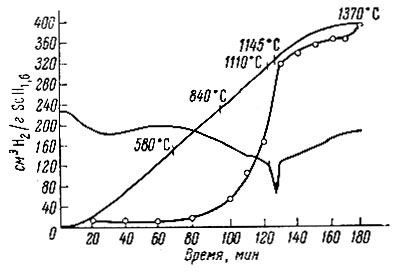
Рис. 4. Термограмма разложения ScH1,6
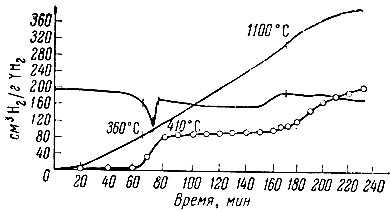
Рис. 5. Термограмма разложения YH2
В заключение авторы выражают искреннюю признательность Н. П. Сажину, Р. М. Либерман и А. Н. Остроуховой за содействие в работе.
Литература
- С. Winkler. Вег., 24, 873 (1891).
- W. Muthmann, К. Kraft. Ann., 325, 263 (1902).
- W. Muthmann, H. Beck. Ann., 331, 58 (1904).
- R. Vial lard, P. Yasczyn. Compt. rend., 228, 485 (1948).
- K. Dialer, B. Frank. Z. Naturforsch., 15b, 57 (1960).
- C. Holley, R. Mu 1 ford. J. Phys. Chem., 59, 1226 (1955).
- R. Mulford, C. Holley. J. Phys. Chem., 59, 1222 (1955).
- J. С. Mс Guire, C. P. Kempter. J. Chem. Phys., 33, 1584 (1960).
- C. Winkler. Ber., 24, 1966 (1891).
- K. Dialer, B. Frank. Z. Naturforsch., 15b, 58 (1960).
- В. И. Михеева, М. E. Кост. ЖНХ, 3, 260 (1958).
- М. E. К ост. ДАН СССР, 143, 119 (1962)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'