
Получение и физико-химические свойства карбидов и нитридов редкоземельных элементов (Г.В. Самсонов, Т.Д. Косолапова, М.Д. Лютая, Г.Н. Макаренко)
Карбиды и нитриды рзэ, иттрия и скандия, представляющие интерес как фазы со сложными типами связи между атомами металла и металлоида, изучены недостаточно.
Карбид скандия впервые был получен Фридерихом и Зиттиг [1], которые приписали ему формулу Sc4C3. Позже [2] был получен карбид ScC с кубической решеткой типа NaCl и предположено существование карбида Sc2C с гексагональной структурой. Виккери и сотрудники [3] подтвердили существование монокарбида скандия, имеющего гексагональную структуру. Новотным и Ауэр-Вельобах [4] проведено исследование условий получения монокарбида скандия восстановлением Sc2O3 углеродом при температурах выше 2000° С в атмосфере защитного газа. Продукты реакции согласно рентгенографическим данным, наряду с SC2O3 и графитом, содержат фазу с кубической структурой типа NaCI и периодом а = 4,48 kX. Наличие Sc2O3 в продуктах реакции приводит авторов к предположению об образовании карбида с дефицитом атомов углерода ScC1-x или оксикарбида Sc (С,О).
Эти же авторы [5] получали карбид скандия синтезом из элементов при 2500° С. Результаты рентгенографического исследования подтверждают образование ScC, характеризующегося кубической гранецентрированной решеткой, но наряду с этим на рентгенограммах обнаруживаются значительные количества металлического скандия и графита. С целью изучения взаимодействия ScC с другими карбидами был получен сплав (Sc0,25, Ti0,75)C, имеющий также структуру типа NaCl, на основании чего сделали вывод о взаимной растворимости ScC и TiC.
В системе Y - С установлено существование четырех фаз: Y3C, YC, Y2C3, YC2 [3, 6-9]. Фаза Y3C кристаллизуется в кубической гранецентрированной решетке и имеет состав, соответствующий Y4C и Y5C2.
Указывают также [3, 6], что рзэ не образуют монокарбидов. Однако сделано предположение [4] о существовании карбида YC со структурой типа NaCl и с параметром, близким к параметру YN (а = 4,877A). Это предположение подтверждено нашими исследованиями [8]. Данных о структуре и свойствах карбида Y2C3 в литературе нет. Дикарбид YC2 изучен в этой системе наиболее подробно. Он имеет гексагональную решетку с периодами а = 3,80, с = 6,67 А [7]. Однако более поздними исследователями [3, 6] показано, что он кристаллизуется в объемноцентрированной тетрагональной решетке типа СаСl2 с периодами а = 3,664, с = 6,196 А.
Систему La - С изучали Спеддинг и сотрудники [6]. В результате исследования в указанной системе установлено существование двух фаз - La2C3 и LaC2. Полуторный карбид гомогенен в области 56,2- 60 ат. % углерода. У дикарбида область гомогенности практически отсутствует. Исследование условий получения LaC2 восстановлением La2O3 углеродом в вакууме [10] показало, что при 1850-1900° С реакция идет с образованием LaC2, близкого по составу к расчетному.
Наиболее полно условия получения и некоторые свойства нитрида скандия изучили Фридерих и Зиттиг [1]. При восстановлении окиси скандия углеродом в токе азота при температурах выше 1300° С ими получен продукт, содержащий лишь 15% нитрида. Благоприятное влияние на состав продукта реакции оказывает прибавление в шихту 10% Fe2O3 или 10% Na2C03, что увеличивает содержание ScN в нем до 95-96%. Используя хорошо очищенный азот, авторы получили чистый нитрид при 1700-1800° С.
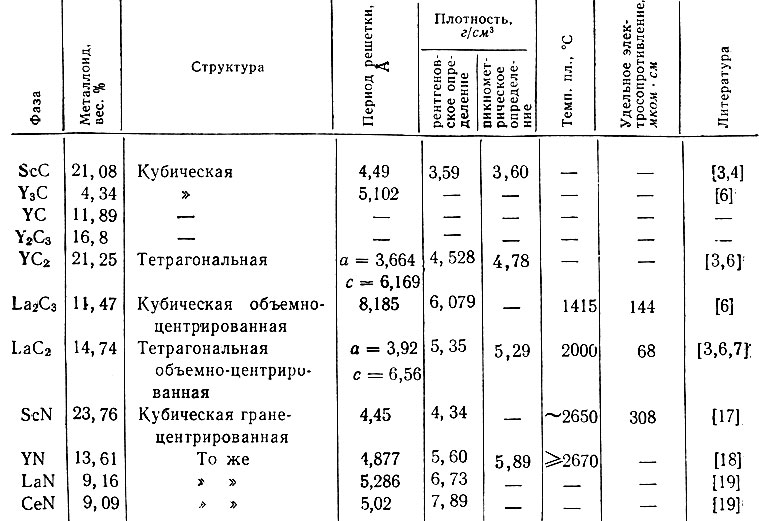
Таблица 1. Свойства карбидов и нитридов Sc, Y, Се и La
Нитрид церия CeN также впервые пытались получить Фридерих. и Зиттиг [1] восстановлением окиси церия углеродом в токе азота. Однако при 1250-1600° С в продуктах восстановления нитрид церия практически не обнаруживали. Матиньо [11] получил CeN восстановлением. СеO2 магнием или алюминием в атмосфере азота; Мутман и Крафт [12] - азотированием металлического церия. Оказалось, что при температурах до 500° С азотирование идет медленно, при 850° С поглощение азота церием резко возрастает и сопровождается сильным разогревом. Однако Даферт и Миклауц [13] не смогли получить этим методом CeN и предложили получать его нагреванием гидрида церия в токе азота при, 800-900° С. Нитрид церия образуется также при нагревании карбида церия в азоте или аммиаке при 1250° С, причем реакция с азотом идет быстрее, чем с аммиаком [14].
Первые опыты получения нитрида лантана [1] нагреванием смеси La203 с углеродом в токе азота показали, что образование LaN начинается при 1300° С, при 1500-1700° С образуется смесь нитрида с карбидом лантана. Наиболее распространенный метод получения нитрида лантана - нагревание опилок или стружки металлического лантана в токе азота [12, 15, 16]. Опилки лантана [16], приготовленные измельчением куска металла в атмосфере сухого гелия или азота, нагревают при 600° С в течение часа, затем при 750° С - от 2 до 4 час. и при 900° С - от 1 до 2 час. Полная гомогенизация достигается за 20 час. при 900° С. Некоторые свойства описанных карбидов и нитридов приведены в табл. 1.
В настоящей работе были изучены условия получения карбидов Sc, Y и La, нитридов Sc, Се и La, а также их некоторые физико-химические свойства.
Экспериментальная часть
Условия получения карбидов исследовали при восстановлении соответствующих окислов сажей в вакууме. Кроме того, изучали влияние температуры, времени нагрева и состава шихты на состав продуктов реакции. Исследование условий получения нитридов Sc, Се и La проводили азотированием соответствующих металлов азотом или аммиаком в кварцевых реакторах, помещенных в шахтные печи с силитовыми нагревателями [20]. В случае нитрида скандия также изучали процесс восстановления Sc2O3 сажей с одновременным азотированием посредством азота в графито-трубчатых печах типа Таммана.
Исходными материалами служили Sc2O3 и Y2O3 (х. ч.), металлический 98,0%-ный скандий, 98,5%-ный Се, ламповая сажа зольностью 0, 12-0,15%, азот, содержащий 0,12% кислорода, и аммиак. Азот дополнительно очищали от кислорода гранулированной медью, нагретой до 600° С, и высушивали над СаСl2 или Р2O5.
Продукты реакции подвергали химическому анализу. В карбидах определяли содержание металла, общего и свободного углерода. Содержание связанного углерода (%) определяли по разности между содержанием общего и свободного углерода, отнесенной к карбидной фазе: т. е.
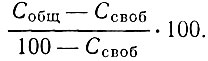
В нитридах определяли содержание металла, азота, в отдельных случаях - общего и свободного углерода; при получении нитрида скандия восстановлением Sc2O3 определяли также содержание Sc2O3 в продуктах реакции.
Рентгеновский анализ* производили при помощи камеры РКУ-114 в медном излучении.
* (Рентгеновский анализ образцов выполнен О. Т. Хорпыковым)
Методы получения и свойства карбидов
Карбид скандия. Реакция Sc2O3 + 5С = 2ScC + 3СО начинается при 1300-1400° С и с увеличением температуры до 1900° С содержание связанного углерода в продуктах реакции возрастает, не достигая, однако, расчетного - 21,02% (табл. 2). При 1900°С образец плавится и содержание связанного углерода резко увеличивается, достигая более высокого значения по сравнению с рассчитанным для ScC. Суммарное содержание скандия и углерода в продуктах реакции до плавления значительно меньше 100% (восстановление неполное).
Изменение состава шихты и времени выдержки при 1800-2000° С не вызывает изменений в содержании связанного углерода и кислорода, количество которого определяется по разности 100-(Sc + С) %.
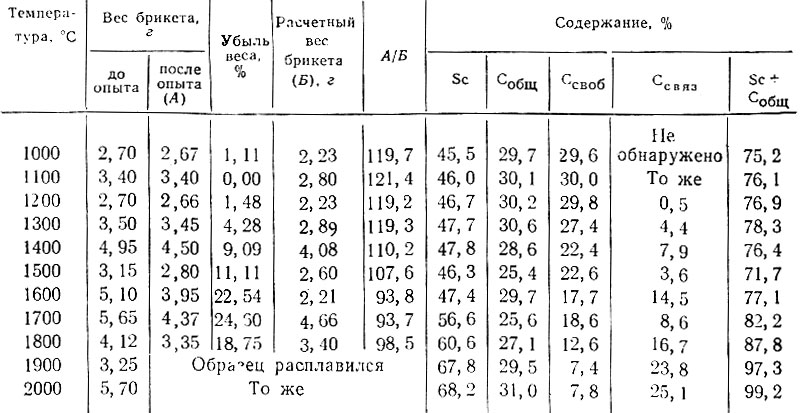
Таблица 2. Условия получения карбидов скандия. Расчетный состав ScC : Sc - 78,98%; С - 21,02%. Шихта стехиометрического состава, время нагрева 1 час
Увеличение содержания связанного углерода в образцах, полученных при температурах выше 1900° С, позволило предположить существование высших по содержанию углерода карбидов скандия - Sc2C3 и ScC2. Однако получить эти карбиды не удалось - во всех опытах содержание связанного углерода при температурах до 1900° С не превышало 10- 15%, а при более высоких температурах достигало 24-25% по сравнению с 28,58% Для Sc2C3 и 34,8% для ScC2.
Резкое увеличение содержания связанного углерода при плавлении свидетельствует о том, что образование монокарбида скандия происходит из расплава; при этом углерод растворяется в карбиде. Для предотвращения возможности растворения углерода в карбиде проводили опыты по получению карбида в патронах из нитрида бора и азотированного карбида бора. Максимальное содержание связанного углерода {18-19%) было получено при использовании шихты с 10%-ным избытком сажи по отношению к стехиометрическому составу. Образцы одновременно содержали до 6% свободного углерода. Таким образом, получить монокарбид скандия предельного состава не представляется возможным; в результате реакции, по-видимому, образуется оксикарбид, состав которого приближенно соответствует формуле Sc2C20.
В работе была сделана попытка стабилизировать карбид скандия растворением в нем карбида титана, для чего проводили совместное восстановление окислов скандия и титана сажей в вакууме в расчете на получение сплавов состава:
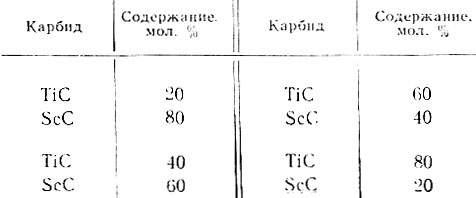
Все сплавы содержат светлую фазу на основе TiC, количество которой возрастает по мере увеличения TiC. Эта фаза характеризуется высокой микротвердостью (5400 кГ/мм2), значительно превышающей микротвердость карбида титана, равную 3000 кГ/мм2. Кроме того, наблюдается более темная фаза на основе ScC.
Некоторые свойства полученных сплавов приведены в табл. 3.
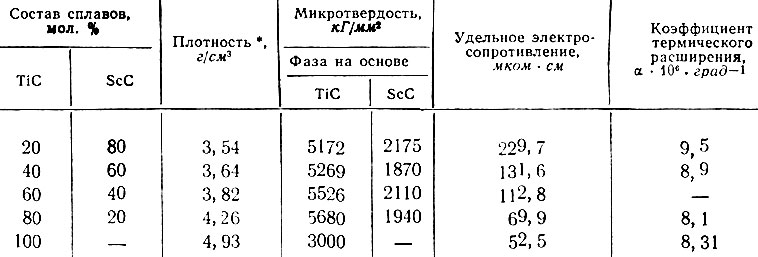
Таблица 3. Некоторые свойства сплавов TiC - ScC
* (Определена пикнометрическим методом. )
Как следует из этих данных, одна из фаз сплавов TiC - ScC имеет исключительно высокую твердость, превышающую 5000 кГ/мм2. Такое резкое возрастание твердости фазы на основе TiC - следствие высокой степени незаполненности ^-электронной оболочки скандия, являющегося наиболее акцепторно-способным среди переходных металлов [21].
Эти сплавы должны, по-видимому, характеризоваться также высокими температурами плавления и пониженными давлениями испарения по сравнению с TiC при нагревании их в вакууме и иметь высокое электрическое сопротивление, снижающееся с уменьшением содержания карбида скандия до значений, близких к электрическому сопротивлению карбида титана.
Карбиды иттрия.
Исследование условий получения карбидов иттрия по реакциям
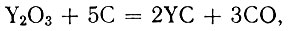 (1)
(1)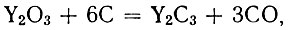 (2)
(2)
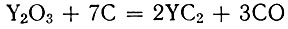 (3)
(3)
подтвердило прежние данные о существовании монокарбида YC. Монокарбид, близкий по составу к стехиометрическому, образуется при 1800-1900° С, полуторный карбид - при 1700-1800° С, дикарбид - при 1900° С.
При 1700-1900° С в процессе получения монокарбида иттрия свободный углерод в продуктах реакции практически отсутствует, а содержание связанного углерода выше рассчитанного для YC; суммарное содержание иттрия и общего углерода 100% (рис. 1). При этих температурах, по-видимому, образуется оксикарбид иттрия, примерный состав которого соответствует формуле Y2C20. С возрастанием температуры кислород из оксикарбида удаляется в форме СО, что подтверждается уменьшением содержания связанного углерода от 14,1% при 1700°С до 12,0% при 1900°С.
При температуре выше 1900° С монокарбид плавится, разлагаясь с образованием иттрия, частично испаряющегося в вакууме, и богатой углеродом жидкой фазы.
Оксикарбиды образуются также при получении полуторного карбида (рис. 2); при получении дикарбида образования их не наблюдается (рис. 3).
В случае получения карбидов вакуумно-термическим методом нагревание обычно проводят до практически полного падения давления в печи, свидетельствующего об окончании реакции. Однако в случае приготовления YC и Y2C3 это не удалось, так как продукты восстановления из-за высокой упругости паров испарялись в вакууме. После нагревания дикарбида в течение 2-3 час. при температурах до 2000° С давление в системе снижается до первоначального, что свидетельствует об его высокой устойчивости в вакууме и низком давлении пара.
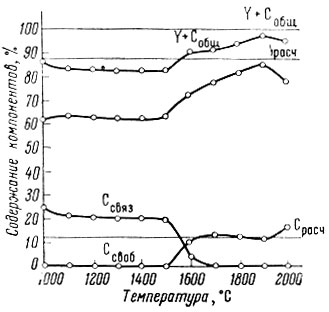
Рис. 1. Зависимость состава продуктов реакции от Y2O3+5C=Y2C3+3CO температуры
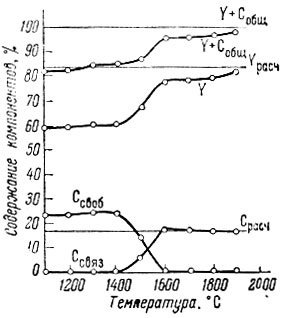
Рис. 2. Зависимость состава продуктов от Y2O3+6C=Y2C3+3CO температуры
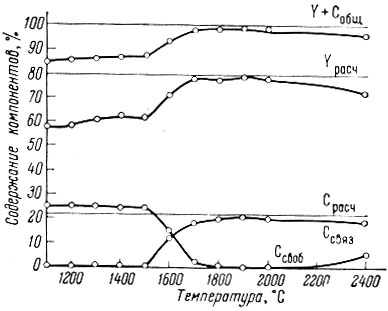
Рис. 3. Зависимость состава продуктов реакции Y2O3+7C=Y2C3+3CO от температуры
Изучение некоторых свойств карбидов иттрия проводили на компактных образцах, полученных горячим прессованием при следующих режимах:

Остаточная пористость полученных образцов составляла 1,5-3%.

Рис. 4. Микроструктура горячепрессованных образцов карбидов иттрия. а - YC; б - Y2Cs; в - YC2
Структуры карбидов YC, Y2C3 и YC2, приведенные на рис. 4, свидетельствуют об однофазности полученных продуктов.

Таблица 4. Некоторые свойства карбидов иттрия
* (Определен пикнометрическим методом)
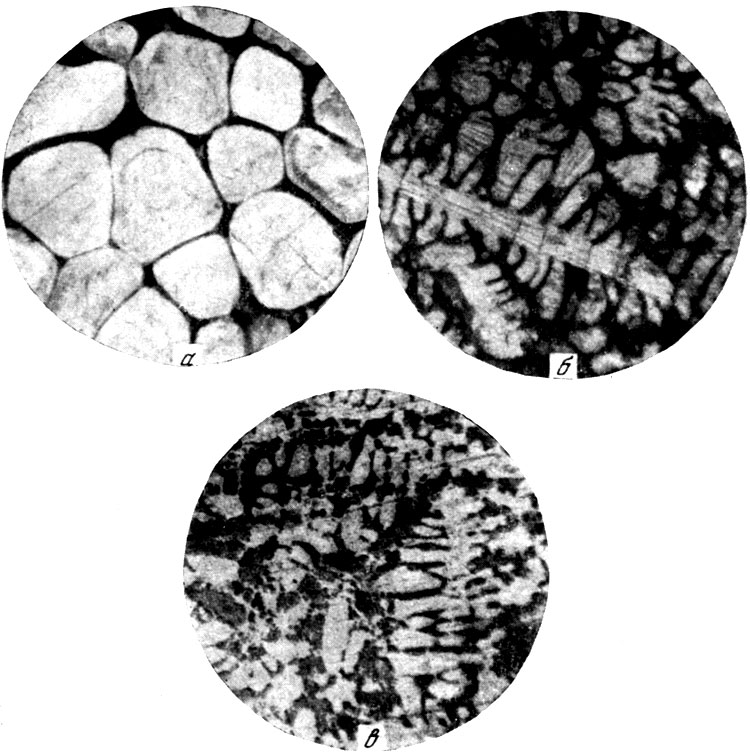
Рис. 5. Микроструктура плавленных образцов карбидов иттрия. а - YC; б - Y2C3; в - YC2
Микроструктура плавленных образцов свидетельствует о появлении вокруг кристаллитов ободков, являющихся признаком перитектического разложения (рис. 5).
Результаты исследования свойств карбидных фаз иттрия приведены в табл. 4. Исследование поведения карбидов иттрия на воздухе при комнатной температуре (рис. 6) указывает на резкое увеличение веса на начальных стадиях окисления для YC и Y2O3 до некоторого максимума, что, по-видимому, связано с образованием оксикарбидов. В дальнейшем оксикарбиды переходят в Y2O3 через стадии образования более богатых кислородом продуктов. Процесс этот протекает очень медленно и даже после пребывания на воздухе в течение 75 час. в продуктах окисления содержится еще около 3% С.
Окисление дикарбида происходит медленнее, чем моно- и полуторного карбида, и без образования оксикарбидов.
Под действием воды, растворов разбавленных кислот и щелочей порошки карбидов иттрия легко разлагаются; концентрированные кио. лоты, за исключением соляной, разлагают их медленно.
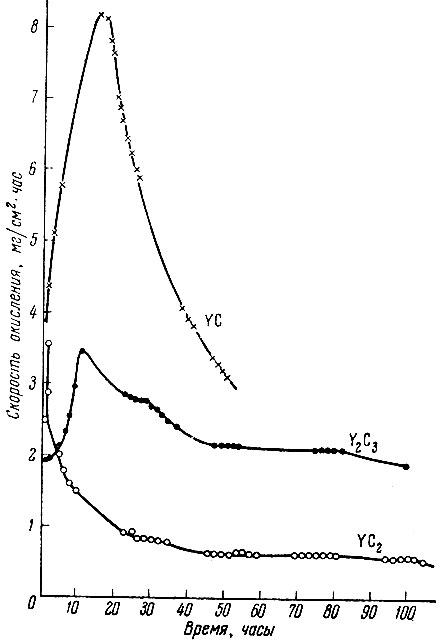
Рис. 6. Зависимость скорости окисления карбидов иттрия на воздухе от температуры
Наибольшей химической стойкостью характеризуется дикарбид иттрия (табл. 5).
Электрическое сопротивление карбидов иттрия закономерно уменьшается от низшего карбида YC до высшего YC2, т. е. с увеличением отношения С/Y, причем сопротивление низшего карбида характерно для полупроводников, а высшего - для металлоподобных карбидов IV-VI групп периодической системы. Дикарбид иттрия характеризуется также более высокой температурой плавления, микротвердостью, химической устойчивостью, что свидетельствует о некотором изменении характера связи при переходе от моно- к дикарбиду.
Атом иттрия характеризуется высокой степенью незаполненное d-электронной оболочки и при взаимодействии с углеродом поляризуется отрицательно, а атом углерода риобретает положительный заряд за счет перехода его 2р- и 2s-электронов к остову атома иттрия. Это вызывает появление в решетке монокарбида иттрия широкого энергетического разрыва и соответственно высокого электрического сопротивления. С увеличением отношения С/Y появляется большая доля ковалентной связи между атомами углерода, на образование которой расходуются в основном 2p-электроны. При этом степень поляризации атомов иттрия уменьшается, а в случае YC2 образуются связи металлического типа между атомами иттрия и структурными конфигурациями из атомов углерода.
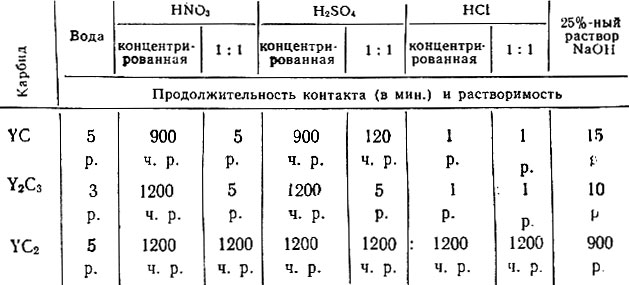
Таблица 5. Химическая стойкость карбидов иттрия при 20°С
* (р. - растворяется; ч. р. - частично растворяется.)
Сочетание металлической и ковалентной связей обусловливает относительно высокие температуры плавления, микротвердость и химическую стойкость дикарбида иттрия. Конгруэнтное плавление YC2 и его относительно невысокая упругость паров характерны для металлоподобного состояния. Знак термоэлектродвижущей силы у всех карбидов иттрия свидетельствует о том, что они обладают электронной проводимостью; при этом значение термоэлектродвижущей силы снижается от ионного монокарбида до ковалентно-металлического дикарбида.
Карбид лантана
Исследование условий прохождения реакции La203 + 7С = 2LaC2 + 3СО (табл. 6) показало, что образование карбида лантана начинается при 1500° С. При 1700° С содержание связанного углерода в продуктах реакции близко к теоретическому для LaC2 и практически не изменяется при дальнейшем увеличении температуры до 2000° С.
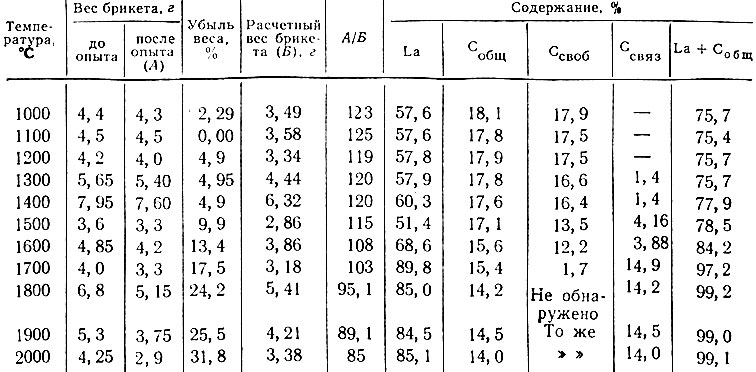
Таблица 6. Результаты опытов по проведению реакции La203 + 7С = 2LaC2 + 3СО в вакууме. Расчетный состав LaC2 : La - 85,27%; С -14,73%. Шихта стехиометрического состава, время нагрева 1 час
Карбид лантана растворяется в разбавленных и концентрированных НСl и HNO3, а также в растворах щелочей. В концентрированной H2S04 растворяется лишь частично.
Условия получения нитридов
Нитрид скандия
Исследование условий восстановления SC2O3 углеродом в атмосфере азота по реакции
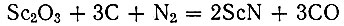
показало (рис. 7), что процесс азотирования начинается при 1400° С, но тогда содержание азота в продукте реакции незначительно; оно резко увеличивается при 1600° С.
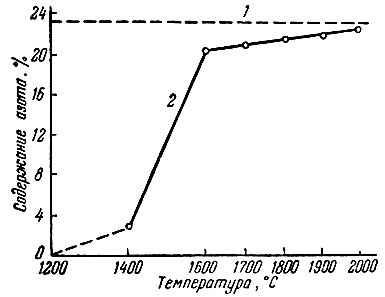
Рис. 7. Зависимость содержания азота в продуктах реакции SC2O3 + 3С + N2 = 2ScN + 3СО от температуры (время азотирования 1 час). 1 - расчетное содержание азота в ScN; 2 - экспериментальные данные
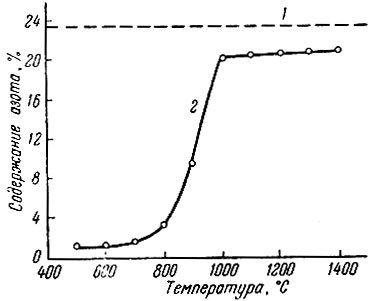
Рис. 8. Зависимость содержания азота в продуктах азотирования скандия азотом от температуры. 1 - расчетное содержание азота в ScN; 2 - экспериментальные данные
Использование углекислого аммония в качестве разрыхлителя шихты при 1600 и 1700° С интенсифицирует процесс азотирования, приводя к более полному и равномерному азотированию.
Однако содержание ScN в продуктах реакции при 1700° С составляет 86-87%. При 1800° С в присутствии разрыхлителя образуется продукт, содержащий 90,5% ScN, загрязненный примерно на 3,5% карбидом скандия. Повышение температуры до 2000° С приводит к образованию нитрида состава ScN0,945 - ScN0,955.
Рентгеновский анализ продуктов азотирования обнаруживает кубическую решетку типа NaCl с периодом а = 4,499 ± 0,0002 А. Увеличение периода решетки по сравнению с литературными данными для ScN (4,45 А), возможно, связано с наличием в продуктах реакции небольших примесей в виде карбида или оксикарбида скандия.
Получить ScN стехиометрического состава этим методом не удалось.
В случае азотирования металлического скандия (рис. 8) взаимодействие начинается при 500° С, но при этом содержание азота в продуктах реакции очень мало. С повышением температуры содержание азота увеличивается, и при 1000° С и более образуется однофазный продукт, соответствующий составу ScN0,891, имеющий кубическую решетку с периодом а = 4.503 ± 0,0005 А.
Нитрид церия
Результаты опытов по азотированию металлического церия азотом в течение часа представлены на рис. 9. Азотирования церия до 800° С практически не происходит. При 800° С сразу образуется нитрид состава CeN, что хорошо согласуется с данными Мутмана и Крафта [12], которые наблюдали такое "скачкообразное" образование нитрида церия при 850° С. Последняя близка к температуре плавления металлического церия (815° С). Азотирование при плавлении церия протекает с большой скоростью, вероятно, вследствие уничтожения тонкой пленки нитрида, препятствующей проникновению азота, и относительно высокой упругости паров церия при температуре плавления. При таком "скачкообразном" образовании нитрида наблюдается сильный разогрев смеси, что обусловлено малой теплотой плавления церия по сравнению с теплотой, выделяющейся при образовании нитрида.
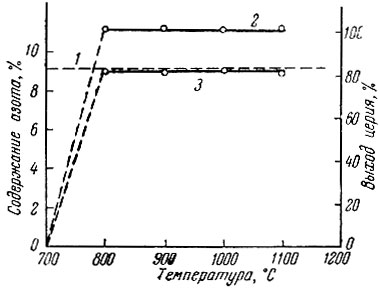
Рис. 9. Зависимость содержания азота в продуктах азотирования церия азотом от температуры ( время азотирования 1 час). 1 - расчетное содержание CeN; 2 - выход церия в продуктах азотирования; 3 - содержания азота в продуктах азотирования
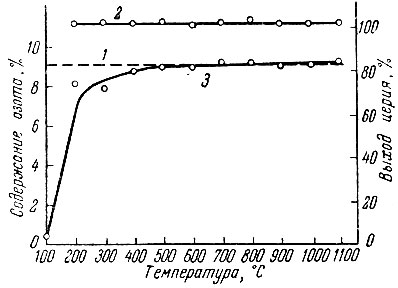
Рис. 10. Зависимость содержания азота в продуктах азотирования церия азотом от температуры ( время азотирования 1 час). 1 - расчетное содержание CeN; 2 - выход церия в продуктах азотирования; 3 - содержания азота в продуктах азотирования

В случае рентгеновского анализа продуктов азотирования при 800° С и выше обнаружена кубическая фаза типа NaCl с периодом а = 5,023 А (табличные данные 5,021 А).
Несколько отличаются результаты опытов при азотировании металлического церия аммиаком (рис. 10), когда азотирование начинается уже при 100° С, а при 200° С содержание азота в продуктах реакции резко увеличивается, достигая примерно расчетного при 500° С, после чего практически не изменяется.
В этом случае процесс азотирования происходит через гидрирование церия водородом аммиака; скорость гидрирования максимальна при 200° С [19]. Образование гидрида предотвращает наличие сплошной пленки нитрида на металлическом церии, препятствующей диффузии азота, кроме того, замена в решетке гидрида атомов водорода атомами азота выгодна термодинамически (теплота образования нитрида и гидрида церия равна соответственно 87 и 42 ккал/моль).
Нитрид лантана
Результаты опытов по азотированию металлического лантана азотом (рис. 11) показывают, что до 800° С происходит медленное взаимодействие лантана с азотом. При 800° С содержание азота в продуктах реакции увеличивается, приближаясь к расчетному для LaN, не изменяясь в дальнейшем с увеличением температуры и времени выдержки.
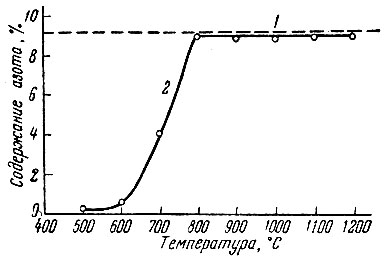
Рис. 11. Зависимость содержания азота в продуктах азотирования церия азотом от температуры ( время азотирования 1 час). 1 - расчетное содержание LaN; 2 - выход церия в продуктах азотирования; 3 - содержания азота в продуктах азотирования
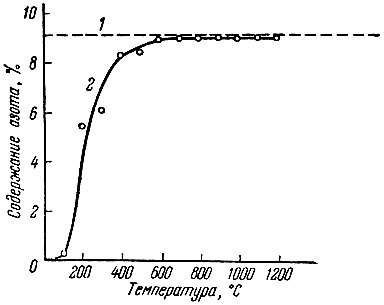
Рис. 12. Зависимость содержания азота в продуктах азотирования церия азотом от температуры ( время азотирования 1 час). 1 - расчетное содержание LaN; 2 - выход церия в продуктах азотирования; 3 - содержания азота в продуктах азотирования
Рентгеновский анализ продуктов реакции, полученных при температурах выше 800° С, обнаруживает кубическую решетку типа NaCl с периодом 5,302 ± 0,002 А (расчетное значение периода 5,295 А).
Азотирование металлического лантана аммиаком (рис. 12) начинается при 200° С, но продукты, близкие по составу к LaN, образуются при 600° С. Дальнейший рост температуры и времени азотирования не изменяет практически состава продуктов реакции.
В данном случае, аналогично процессу азотирования церия аммиаком, наблюдается образование гидрида лантана с последующей заменой атомов водорода в решетке атомами азота.
Литература
- Е. Friеdеriсh, L. Sittig. Z. anorg. Chem., 144, 186 (1925).
- B. Jacobson, A. Westgren. Z. phys. Chem., 20, 361 (1933).
- R. Viickery. R. Sedlaсek, A. Ruben. J. Chem. Soc., 159, 503 (1959).
- H. Auer-Welsbach, H. Nowotny. Monatsh., 92, 198 (1901).
- H. Nowotny, H. Auer-Welsbach. Monatsh., 92, 789 (1961).
- F. Spedding, K. Gsсhneider, A. Daane. J. Am. Chem. Soc., 80, 4499 (1958).
- M. Stасkelberg. Z. Elektrochem., 37, 542 (1936).
- Г. В. Самсонов, Г. H. Макаренко, Т. Я. Косолапова. ЖПХ, 34, 1444 (1961) .
- Г. В. Самсонов, Т. Я. Косолапова, Г. Н. Макаренко. ЖНХ, 7, 975 (1962) .
- М. С. Ковальченко, В. С. Нешпор, Г. В. Самсонов. ЖПХ, 31, 1427 (1958).
- И. С. Matignon. Compt. rend., 131, 837 (1900).
- W. Muthmann, К. Kraft. Ann. Chim., 325, 268 (1902).
- E. Dafert, К. Miklauz. Monatsh., 33, 911 (1912).
- F. Fichter, C. Schollig. Helv. chim. acta, 3, 164 (1920).
- B. Neumann, C. Kroger, N. Kunz. Z. anorg. Chem., 207, 133 (1932).
- Руководство по препаративной неорганической химии. Под ред. Г. Брауэра. М., ИЛ, 1956.
- К. Becker, F. Ebert. Z. Physik, 31, 218 (1925).
- С. Kemp ter, N. Кrikоrian, I. Me Quire. J. Phys. Chem., 61, 1237 (1957).
- A. Jandelli, E. Воlli. Atti accad. noze. Lincei, Classe sci. ris. mat. nat.. 25, 129 (1937).
- Т. С. Вepxоглядова, Т. В. Дубовик, Г. В. Самсонов. Порошковая металлургия, № 4, 9 (1961).
- Г. В. Самсонов, Г. Н. Макаренко, Т. Я. Косолапова. ДАН СССР, 144, 1062 (1962).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'