
Получение и свойства силицидов некоторых редкоземельных элементов (Г.В. Самсонов, В.С. Нешпор, Ю.Б. Надерно)
Силициды некоторых рзэ представляют практический интерес в связи с возможностью их использования в ряде областей новой техники, в частности в ядерной энергетике [1, 2]. Эти соединения представляют значительный теоретический интерес также и с точки зрения их кристаллохимии и специфических физических свойств. Некоторые из них характеризуются полупроводниковыми свойствами при высоких температурах [3]. В литературе опубликовано лишь несколько работ [4-11] по исследованию силицидов рзэ, относящихся в основном к изучению их кристаллической структуры.
В качестве исходных веществ для получения силицидов рзэ чаще всего используют окислы или фториды, которые восстанавливаются кремнием. Описано [2, 4, 5] получение силицидов La, Се, Рг, Nd, Sm, Gd, Eu, Dy и Y состава LnSi2 путем восстановления окислов металлов кремнием в вакууме. Однако механизм взаимодействия окислов рзэ с кремнием и характер промежуточных продуктов ,не исследованы.
Брауэр и Хааг [4] предполагали, что получению дисилицида церия путем восстановления СеО2 кремнием предшествует образование Si02, но убедительных доказательств не привели.
В настоящей работе был исследован характер взаимодействия окислов La, Се, Y, Nd и Sc с кремнием в вакууме при высоких температурах. Смеси порошков кремния и окислов рзэ, составленные в предположении реакций

прессовали в брикеты и загружали в графитовый патрон-нагреватель в вакуумной печи, конструкция которой описана в литературе [12]. Брикеты устанавливали на подставку из силицированного графита так, чтобы они не касались боковых стенок патрона. Было исследовано изменение давления в реакционном пространстве в зависимости от температуры и времени реакции, химический состав и кристаллическая структура образующихся фаз в продуктах реакции.
Получение силицида лантана
На рис. 1 показана зависимость давления паров SiO в реакционном пространстве печи от времени реакции при постепенном увеличении температуры.
При начальном давлении в печи ~ 10-3 мм рт. ст. реакция интенсивно протекает при 1300°, чему отвечает резкое повышение давления SiO. Через 30 мин. реакция заканчивается, давление падает до первоначального и в дальнейшем не изменяется даже при повышении температуры до 1350° С, Повышение же температуры до 1400° С приводит к новому скачку давления. Это второе повышение давления продолжается около 15 мин., после чего снижается до первоначального и далее 'практически не меняется при последующем повышении температуры.
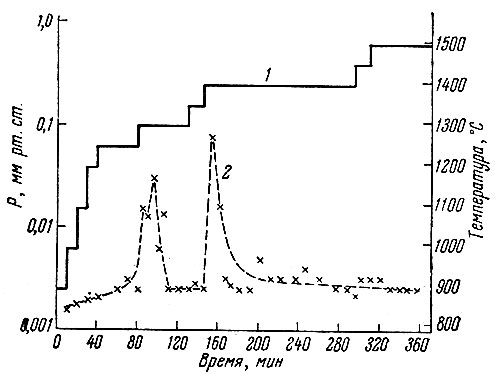
Рис. 1. Зависимость давления паров SiO от температуры и времени реакции восстановления La2O3 кремнием. 1 - температура; 2 - давление
Таким образом, реакция восстановления окиси лантана кремнием протекает в две стадии. Рентгеновский фазовый анализ показал, что продукт реакции соответствует дисилициду лантана [4] и не содержит других фаз. С целью установления природы образующихся промежуточных фаз и выбора наилучшего режима получения LaSi2 был исследован химический и рентгеновский фазовый состав продуктов реакции, полученных при разных температурах.
Образцы нагревали до тех пор, пока давление в печи не начинало приближаться к постоянной величине, что свидетельствовало о достижении квазиравновесных условий.
Изменение давления при различных температурах реакции показано на рис. 2; изменение химического состава продуктов реакции - на рис. 3 и в табл. 1.
С повышением температуры реакции количество свободного кремния непрерывно уменьшается и становится равным нулю при 1600° С. Одновременно содержание лантана и связанного кремния оказывается близким к расчетному для LaSi2 (71,2% La, 28,8% Si).
Штрихдиалраммы рентгенограмм препаратов, полученных при разные температурах, приведены на рис. 4. Образование LaSi2 начинается уже при ~ 1100° С, однако при этом рентгеновская картина дисилицида лантана выделяется недостаточна четко. На порошкограммах, кроме линий LaSi2, наблюдаются линии свободного кремния и некоторые линии Χ-фазы. Последние не совпадают как с линиями LaSi2, так и La203. Особенно четко рентгеновская картина Х-фазы выявляется на порошкограмме препарата, закаленного, начиная с температуры, характерной для первого скачка давления (рис. 1). Положение линий J-фазы нельзя приписать кубической решетке, которую можно было бы ожидать, если предположить, что восстановлению La203 предшествует образование низшего окисла LaO. У последнего по аналогии с LaN, SmO и EuO [13] возможна кубическая структура. По порошкограмме нельзя идентифицировать Х-фазу, однако сравнение рентгенограммы этого препарата с рентгенограммой YSi [14] показало, что линии Х-фазы по расположению и интенсивности обнаруживают некоторое сходство с линиями YSi.
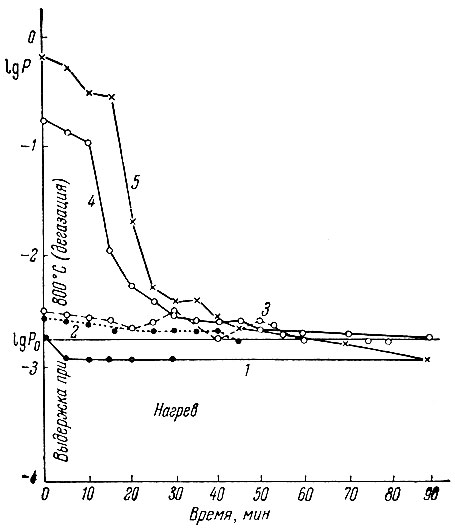
Рис. 2. Зависимость давления паров SiO от времени выдержки смеси окиси лантана и кремния при разных температурах ( в С°): 1- 1150; 2 - 1250; 3 - 1375; 4 - 1490; 5 - 1600
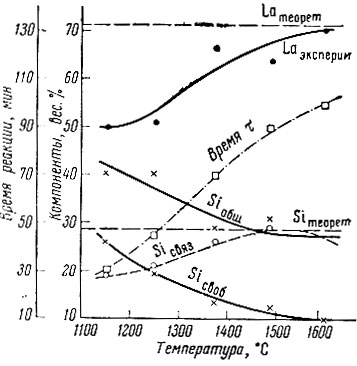
Рис. 3. Зависимости химического соединения продуктов восстановления La2O3 кремния от температуры реакции
![Рис. 4. Штрихдиаграммы рентгенограмм продуктов реакции восстановления LaO2,3 кремнием: 1 - расчетная рентгенограмма LaSi2 [4]; 2 - продукт после первого скачка давления; 3 - 1150°С (30 мин.); 4 - 1250°С (45 мин.); 5 - 1375°С (70 мин.); 6 - 1490°С (90 мин.); 7 - 1600 °С (100 мин.)г а также продукт после второго скачка давления ________ - LaSi><sub>2</sub>, _______ × - Χ - фаза; - - - Si; θ - угол отражений](pic/000038.jpg)
Рис. 4. Штрихдиаграммы рентгенограмм продуктов реакции восстановления La2O3 кремнием: 1 - расчетная рентгенограмма LaSi2 [4]; 2 - продукт после первого скачка давления; 3 - 1150°С (30 мин.); 4 - 1250°С (45 мин.); 5 - 1375°С (70 мин.); 6 - 1490°С (90 мин.); 7 - 1600 °С (100 мин.)г а также продукт после второго скачка давления ________ - LaSi2, _______ × - Χ - фаза; - - - Si; θ - угол отражений
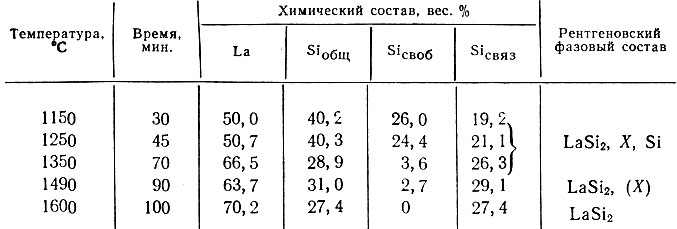
Таблица 1. Химический и фазовый состав продуктов реакции окиси лантана с кремнием
Это позволяет предположить, что Х-фаза представляет собой моносилицид лантана LaSi. С повышением температуры реакции линии фаз X и Si на рентгенограммах ослабляются, а при 1500-1600° С они исчезают. Напротив, четкость рентгеновской картины LaSi2 возрастает, а при 1500-1600° С на порошкограммах видны только линии дисилицида.
Из этих результатов можно заключить, что при 1100-1400° С образуются LaSi и LaSi2, а при более высоких температурах - непосредственно LaSi2.
В связи с этим, можно предположить, что наличие двух скачков давления на рис. 1 связано с протеканием реакции в два этапа:
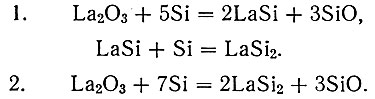
Первый скачок давления при этом связан с образованием LaSi, второй- непосредственно с образованием LaSi2.
То обстоятельство, что реакция, идущая с выделением SiO, не заканчивается на первом этапе, обусловлено, вероятно, пассивирующим действием пленки SiO, которая при низких температурах имеет, по-видимому, недостаточную упругость паров для ее полного удаления и изолирует частицы кремния.
Предполагая, что первый и второй скачки давления на рис. 1 соответствуют образованию LaSi и LaSi2, можно приблизительно оценить теплоты образования ΔHi этих фаз [15] по уравнению
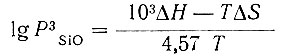
где Т - температура начала скачка давления Psio; ΔН и ΔS - изменение теплоты и энтропии реакции. Неизвестную энтропию LaSi и LaSi2 приближенно рассчитывали по формулам [16].
Вычисленные таким образом теплоты образования LaSi и LaSi2 составляют соответственно 30 и 44,4 ккал/моль.
Теплота образования на 1 г-атом Si для CeSi2 составляет от 16,6 до 34,4 ккал [16], что находится в тех же пределах, что и найденные значения - ΔН для силицидов лантана.
Получение силицида церия
Смеси порошков СеO2 и Si нагревали в вакууме 30 мин. при 1250- 1580° С. Изменение химического состава продуктов реакции в зависимости от температуры показано на рис. 5. Содержание свободного кремния с возрастанием температуры уменьшается и достигает минимального значения при 1470° С, после чего несколько увеличивается. Штрихдиаграммы порошкограмм продуктов реакции приведены на рис. 6. Рентгеновский фазовый анализ показал, что на порошкограммах препаратов имеются линии CeSi2 [4], причем четкость рентгеновской картины CeSi2 возрастает с увеличением температуры. Напротив, интенсивность линий свободного кремния при этом уменьшается, и в высокотемпературных препаратах (особенно при 1470° С) они почти незаметны. Вместе с тем на рентгенограммах обнаруживается новая фаза, которая сохраняется до 1470-1580° С, хотя интенсивность линий этой фазы с повышением температуры уменьшается. Расшифровать структуру этой фазы по дебаеграмме не удалось. Если считать, что весь связанный кремний входит в силицид, то по результатам химического анализа состав силицида при 1470-1580° С отвечает формуле CeSi1,6-1,8, т. е. может содержать смесь силицидов CeSi и CeSi2 недостаток содержания компонентов, согласно анализу, по отношению к 100% показывает, что образцы, по-видимому, содержали некоторое количество кислорода, хотя линии Се02 на рентгенограммах не обнаруживались. Возможно, что кислород в образцах содержится в виде не удалившейся до конца аморфной моноокиси кремния SiO.
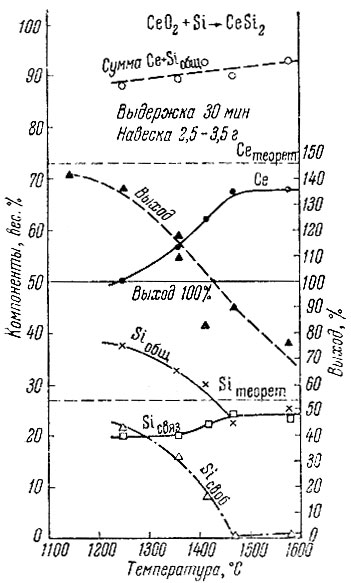
Рис. 5. Зависимость химического состава продуктов восстановления CeO2 кремния от температуры реакции
![Рис. 6. Штрихдиаграммы рентгенограмм продуктов восстановления CeO2 кремнием: 1 - расчетная рентгенограмма CeSi2 [4]; 2 - 1250; 3 - 1300; 4 - 1360; 5 - 1470; 6 - 1580 °С](pic/000043.jpg)
Рис. 6. Штрихдиаграммы рентгенограмм продуктов восстановления CeO2 кремнием: 1 - расчетная рентгенограмма CeSi2 [4]; 2 - 1250; 3 - 1300; 4 - 1360; 5 - 1470; 6 - 1580 °С
Однофазный силицид церия для исследования физических свойств был получен путем прямого синтеза из компонентов. Для проведения синтеза опилки церия, полученные под слоем толуола, смешивали с соответствующим количеством порошка кремния. Смесь спекали при 1300° С в атмосфере аргона.
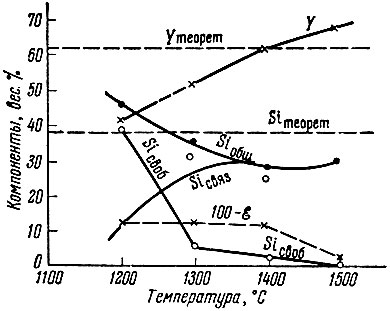
Рис. 7. Зависимость химического состава продуктов восстания Y2O3 кремния от температуры реакции
Таким же методом был получен дисилицид празеодима. Рентгеновский анализ показал, что эти препараты представляли собой однофазные CeSi2 и PrSi2.
Получение силицида иттрия
Химический состав продуктов реакции окиси иттрия с кремнием в зависимости от температуры и времени реакции приведен на рис. 7. Реакцию при каждой температуре проводили до прекращения заметного изменения давления паров SiO в реакционном пространстве. Рис. 8 иллюстрирует зависимость давления паров SiO от продолжительности реакции при различных температурах.
Рентгеновский анализ (рис. 9) показывает, что с 1200 до 1500° С образуется не YSi2, a YSi, причем с повышением температуры реакции четкость рентгеновской картины YSi возрастает. Для идентификации этой фазы использовали данные Амброжия и Гольцева [14], которые получили моносилицид иттрия прямым синтезом. Некоторые линии на рентгенограммах препаратов можно приписать дисилициду YSi2, однако число их весьма невелико и ряд наиболее интенсивных линий этой фазы [5] отсутствует. В интервале 1200-1400° С на рентгенограммах имеются линии окиси иттрия и свободного кремния, интенсивность которых по мере повышения температуры ослабляется, причем ослабление интенсивности и исчезновение линий свободного кремния выражено значительно более заметно. Состав силицида, отвечающего продукту, не содержит свободного кремния ( получения при 1500 °С), выпажает формулой YSi1,4. Таким образом, полученный продукт, по-видимому, кроме моносилицида, содержит некоторого количества дисилицида.
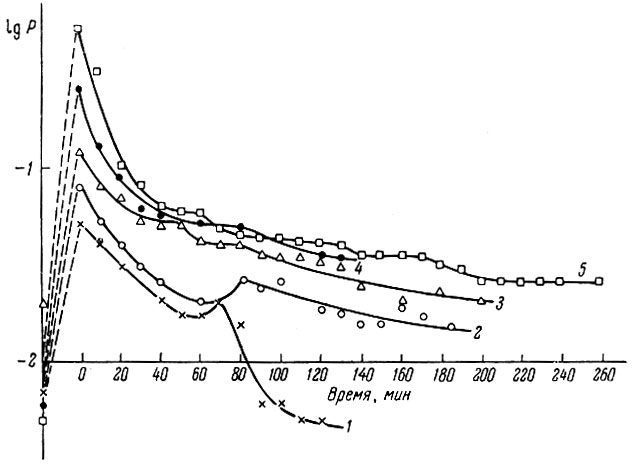
Рис. 8. Зависимость давления паров SiO от продолжительности реакции смеси окиси иттрия и кремния при разных температурах (в °С): 1 - 1200; 2 - 1300; 3 - 1400; 4 - 1500; 5 - 1600
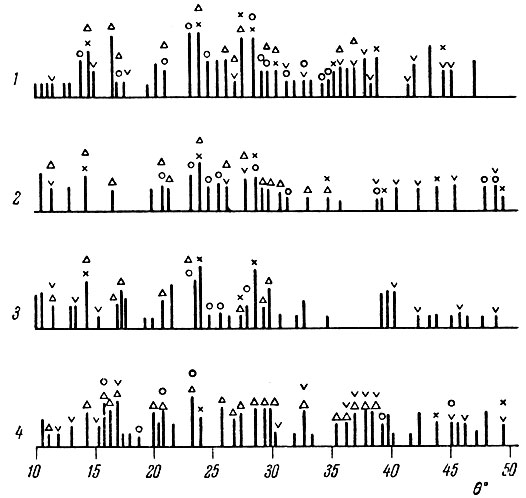
Рис. 9. Штрихдиаграмма рентгенограмм продуктов восстановления Y2O3 кремнием:1 - 1200°С (130 мин.); 2- 1300°С (180 мин.); 2- 1400°С (200 мин.); 1500°С
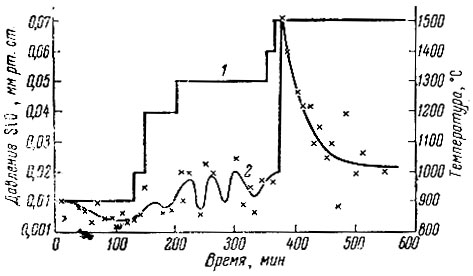
Рис. 10. Зависимость давления паров SiO от температуры и времени реакции восстановления Y2O3 кремния: 1 - температура; 2 - давление
На рис. 10. зависимость давления паров SiO в реакционном пространстве от времени при постепенном подъеме температуры. Интенсивное прохождение реакции начинается при 1500° С, на что указывает резкий и довольно продолжительный подъем давления.
Этот скачок, очевидно, аналогичен первому скачку давления (см. рис. 1) и соответствует образованию моносилицида, на что указывают результаты рентгенвского анализа (рис. 9). Такой вывод находится в соответствии с предположением об образовании моносилицида лантана на первой стадии реакции восстановления окиси лантана кремнием*.
* (Теплота образования (ΔН) YSi, вычисленная на основе измерения давления паров SiO и температур реакции, равна 32,2 ккал/моль.)
Получение силицида неодима
На рис. 11 показана зависимость химического состава продуктов реакции восстановления окиси неодима кремнием. Реакцию при каждой температуре проводили до тех пор, пока давление в реакционном пространстве не достигало приблизительно постоянного значения (рис. 12). Из рис. 11 видно, что содержание свободного кремния сравнительно быстро уменьшается до нуля. Рентгеновский анализ (рис. 13) показывает, что в результате реакции образуется NdSi2 уже при сравнительно низких температурах, но восстановление не происходит полностью, и на рентгенограммах вплоть до 1580° С можно заметить линии Nd203. На рис. 11 приведен усредненный химический состав образцов, однако оказалось, что образцы, полученные при 1470 и 1580° С, неоднородны. На их поверхности образуется плотно спеченная металлического вида корка, а в средней части образца находится пористая рыхлая масса, отличающаяся от корки по цвету. Химический анализ показал, что содержание кислорода в средней части образцов, судя по недостатку общего процентного содержания компонентов по отношению к 100%, значительно больше, чем наружной, части образцов. Линии окиси неодима на рентгенограммах сердцевины образцов выявляются более четко по сравнению с наружной частью образцов. В последних преобладает рентгеновская картина NdSi2.
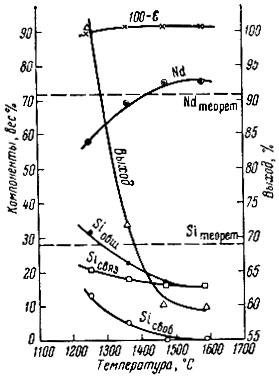
Рис. 11. Зависимость химического состава продуктов восстановления Nd2O3 кремнием от температуры реакции
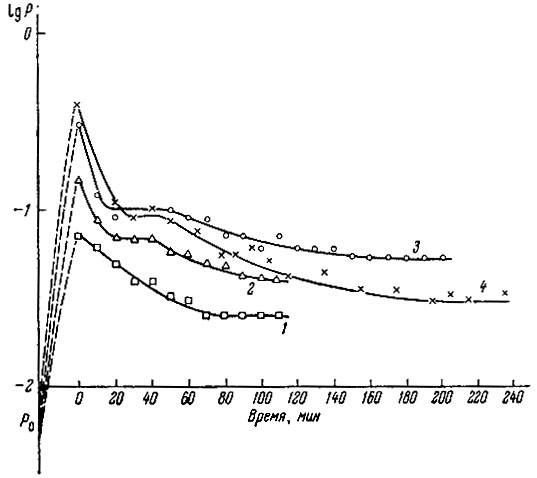
Рис. 12. Зависимость давления паров SiO от времени выдержки смеси неодима и кремния при разных температурах (°С) 1 - 1200; 2 - 1300; 3 - 1400; 4 - 1500
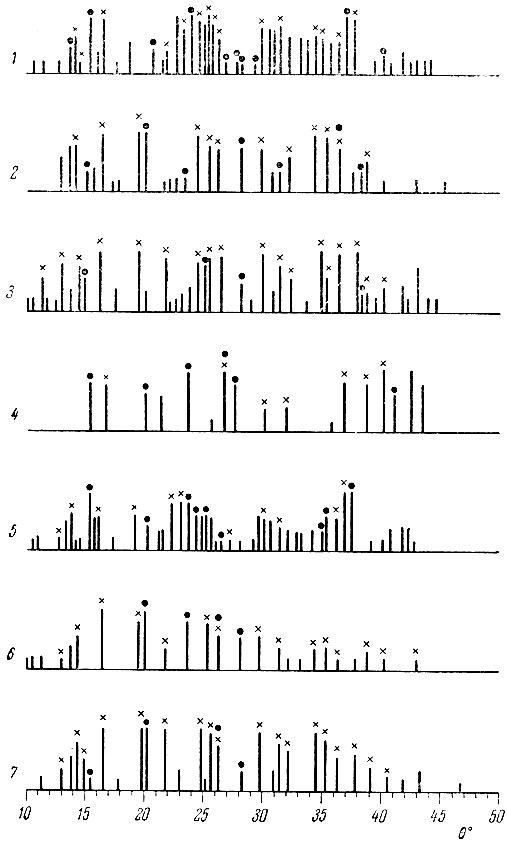
Рис. 13. Штрихдиаграмма рентгенограмм продуктов восстановления кремнием при разных температурах (в ° С): 1- 1200; 2 - 1250; 3 - 1300; 4 - 1360; 5 - 1400; 6 - 1470 ; 7 - 1580 × - NdSi2; ⋅ - Nd2O3
Получение дисилицида гадолиния
Дисилицид гадолиния получали восстановлением окиси гадолиния кремнием при 1000-1800° С в вакууме. На рис. 14 приведены кривые зависимости давления газов в рабочем пространстве печи, согласно которым процесс образования силицида начинается при температурах выше 1200° С и интенсивно проходит при 1500° С. Более высокие температуры приводят к резкому возрастанию давления в печи, что свидетельствует о возгонке продуктов реакции.
Рентгенограмма препарата, полученного при 1500° С, может быть идентифицирована в предположении образования структуры GdSi2, действительный состав которого соответствует GdSi1,3 - GdSi1,4 [8]. На рентгенограмме были обнаружены также некоторые дополнительные линии, по-видимому, соответствующие Si02. Химический состав этого препарата: 60,35% Gd, 26,8% Siсвяз, 0,98% С. Свободный кремний обнаружен не был.
Примерный фазовый расчет показал, что состав полученного силицида соответствует фазе GdSi1,3. Результат вычисления совпадает с данными других исследователей [8].
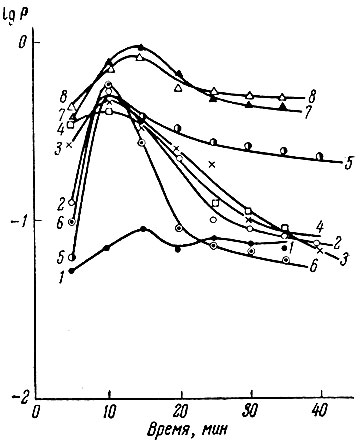
Рис. 14. Зависимость давления паров SiO от времени выдержки смеси окиси гадолиния и кремния при разных температурах (в ° С):1 - 1000; 2 - 1100; 3 - 1200; 4 - 1300; 5 - 1400; 6 - 1500; 7 - 1600; 8 - 1700
Получение силицида скандия
Соединение скандия с кремнием неизвестного состава было впервые синтезировано в 1952 г. [4]. В работе указано, что структура этого соединения не может быть отнесена к известным типам структур рзэ. Есть упоминание [17] о том, что силицид ScSi2 не является сверхпроводником и не переходит в ферромагнитное состояние до температуры 1° К, однако никаких сведений о получении и структуре этого соединения нет.
Нами были проведены опыты для исследования возможности получения силицидов скандия ScSi и ScSi2 при взаимодействии окиси скандия с кремнием в вакууме в интервале температур от 1000 до 1900° С.
Результаты рентгеновского и химического анализов показали, что во всех случаях полного восстановления окиси скандия не происходит, однако при температурах выше 1700° С образуется силицид скандия. Рентгеновскую картину препарата, полученного при 1900° С, расшифровать из-за сложности не удалось. Следует отметить, однако, ее качественное сходство с рентгенограммой моносилицида иттрия. Химический состав продукта, полученного в указанных условиях, следующий: 50,9% Sc, 27,2% Siобщ и 9% SiC.
Проведенный примерный расчет фазового состава продукта по этим данным показал, что состав полученного силицида соответствует моносилициду скандия ScSi.
Кристаллическая структура силицидов редкоземельных элементов
Кристаллическая структура силицидов рзэ была исследована во многих работах [4, 5, 8-11]. Установлено, что дисилициды рзэ кристаллизуются в одном из трех структурных типов - идеальном или ромбическом искаженном типе α-ThSi2, характеризующемся наличием трехмерного каркаса из атомов кремния, в пустотах которого располагаются атомы металла; типе АlВ2 (β-ThSi2) с плоскими сетками из атомов кремния и типе CaSi2 с гофрированными сетками из атомов кремния.
В первом приближении тип структуры силицида определяется соотношением атомных радиусов металла и кремния:

Как видно из приведенных данных, при условии 0,7 < RSi/RMe < 0,8
формируется структура типа α-ThSi2. Рассмотрение межатомных расстояний Si - Si и Si - Me показано,- что атомы кремния связаны ковалентной связью, в то время как связь Me-Si имеет металлический характер.
В идеальном типе α-ThSi2 кристаллизуются дисилициды La, Се, Рг и Еu [15]. Дисилициды Nd, Sm, Gd, Dy и Y [8] при комнатных температурах кристаллизуются в ромбически искаженном типе α-ThSi2, в то время как при температурах выше 300-500° С они переходят в тетрагональную модификацию типа α-ThSi2. У дисилицида празеодима ромбическая структура была обнаружена при температурах ниже 120° С.
Переход в ряду дисилицидов рзэ La - Се - Рr - Nd и так далее от тетрагональной к ромбической решетке при комнатной температуре и увеличение в ряду NdSi2 - SmSi2 - GdSi2 степени "ромбичности" решетки, т. е. разности периодов а и b (соответственно 0,03; 0,07; 0,08; 0,09 А), а также появление у EuSi2 вновь тетрагональной решетки, которая затем опять становится ромбической у GdSi2, можно [18] объяснить эффектом лантановидного сжатия. Однако, с другой стороны, можно предположить, что действительная структура всех дисилицидов рзэ ромбическая, и возникновение тетрагональных структур связано с анизотропией коэффициентов термического расширения вдоль осей а и b.
У периодов решеток силицидов рзэ такая же зависимость от атомного номера, как и у чистых металлов и их боридов [19] - непрерывное уменьшение от LaSi2 до DySi2 (и, по-видимому, далее - до LuSi2) с резким увеличением у силицида европия и, очевидно, иттербия, что определяется различной валентностью соответствующих металлов ( + 2 у Еu и Yb, +3 у остальных рзэ).
Твердость силицидов редкоземельных металлов
Данных о твердости силицидов щелочно- и редкоземельных металлов до настоящего времени нет, за исключением значения микротвердости α-ThSi2 (1120 кГ/мм2) [20], изоморфного со многими силицидами рзэ, и значений твердости дисилицидов лантана и диспрозия (соответственно 31 и 80Ra) [2].
Нами исследовалась микротвердость дисилицидов лантана и церия. Компактные образцы для измерения микротвердости готовили методом горячего прессования [21].
Металлографический анализ показал, что образцы LaSi
Измеренные значения микротвердости приведены в табл. 2, из которой видно, что микротвердость силицидов рзэ значительно меньше твердости силицидов d-переходных металлов, которая имеет порядок 1500-1000 кГ/мм2. Несколько ближе к ним твердость дисилицида тория [20].
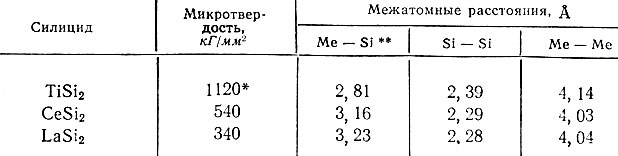
Таблица 2. Микротвердость силицидов и межатомные расстояния в них
* (По данным [20].)
** (Бее расстояния Me - Si приведены к координационному числу 6.)
В табл. 2 приведены также значения межатомных расстояний Me-Si, Si - Si и Me - Me для исследованных силицидов. Твердость силицидов уменьшается с увеличением межатомных расстояний Me - Si, т. е. с ослаблением их связи, тогда как изменение расстояний Me - Me и Si - Si практически не оказывает влияния на твердость. Следует заметить, что более высокая твердость силицидов d-переходных металлов соответствует более коротким межатомным расстояниям Me - Si, а следовательно, более сильной связи между атомами металла и кремния.
Температурная устойчивость силицидов

В ряду LaSi2 - LuSi2 с увеличением атомного номера наблюдается некоторое повышение температуры плавления.
Коэффициент теплового расширения дисйлицида лантана составляет 7,67×10-6 град-1 (20-570°С), что несколько ниже значения для дисилицида бария.
Таким образом, уменьшение теплового расширения, в отличие от возрастания твердости, обусловлено, по-видимому, усилением связи Si - Si или Me - Me, а не Me - Si, что следует из сопоставления значений коэффициента теплового расширения с величинами межатомных расстояний.
Электрические свойства силицидов
Биндер [2] сообщает значения удельного электросопротивления дисилицидов La, Nd, Gd и Dy. Нами исследованы электросопротивление, эффект Холла и термо-э. д. с. дисилицидов La, Рг и Се [22]. Полученные значения вместе с данными Биндера приведены в табл. 3.

Таблица 3. Электросопротивление, коэффициент Холла и термо-э. д. с. силицидов
* (Данные Биндера [2].)
Сообщаемые Биндером значения электросопротивления хорошо согласуются с нашими данными. Вызывает сомнение слишком большое значение электросопротивления DySi2, который как по характеру кристаллической структуры, так и по природе химической связи аналогичен дисилицидам других рзэ.
Дисилициды La, Се и Рг имеют металлический характер. Эффективная концентрация свободных носителей тока в них (электронов в LaSi2 и PrSi2 и дырок - в CeSi2) составляет 1022 см-3, как я в случае самих металлов. В то же время значения удельного электросопротивления дисилицидов рзэ на порядок больше, чем у металлов, что свидетельствует о малой подвижности и большой эффективной массе электронов проводимости в этих веществах. По-видимому, это обусловлено в значительной мере ковалентным характером межатомной связи в соединениях, что следует из рассмотрения их кристаллической структуры. Проведенное исследование электрических и магнитных свойств показало [17], что силициды рзэ не переходят в сверхпроводящее состояние вплоть до температур, близких к 1°К. Дисилициду празеодима ниже 10,5° К свойственен ферромагнетизм.
Литература
- I. Binder, R. Steinitz. Planseeber. Pulvermet, 7, 18 (1959).
- I. Вinder. J. Am. Ceram. Soc., 43, 287 (I960).
- В. С. Нешпор, Г. В. С а он с о н о в. ЖПХ, 33, 993 (I960).
- G. Brauer, Н. Нaag. Z. anorg. Chem., 267, 198 (1952).
- J. Perri, I. Binder, В. Pоst. J. Phys. Chem., 63, 616 (1959).
- I. Sheft, S. Frred. J. Am. Chem. Soc., 75, 1236 (1953).
- O. Runnals, R. Boucher. Acta crystallogr., 8, 592 (1955).
- J, Perry, E. Bunks, В. Pоst. J. Phys. Chem., 63, 2073 (1959).
- W. Zachariasen. Acta crystallogr., 2, 94 (1949).
- E. Jаскоbsоn, R. Freeman, A. Thrap, A. Searcy. J. Am. Chem. Soc., 78, 4850 (1956).
- A. Brown. Acta crystallogr., 14, 860 (1961).
- Г. А. Меерсон, Г. В. Самсонов, М. М. Борисов. Зав. лаб., 19, 169 (1953),
- H. Eick, N. Baenziger, L. Eyring. J. Am. Chem. Soc., 78, 5147 (1956).
- E. Parthee. Acta crystallogr., 12, 559 (1959).
- Г. В. Самсонов. Укр. хим. ж., 32, 287 (1957).
- Г. В Самсонов. ЖПХ, 28, 919 (1955).
- В. Matthias, Е. Korenzwit, W. Zachariasen. Phys. Rev., 112, 89 (1958).
- W. Klemm, H. Bommer. Z. anorg. Chem., 231, 138 (1937).
- Г. В. Самсонов, Ю. Б. Падерно. Бориды редкоземельных металлов. Киев, Изд-во АН УССР, 1961.
- Р. Киффер, П. Шварцкопф. Твердые сплавы. М., Металлургиздат, 1957, стр. 284.
- Г. В. Самсонов. Производство и применение изделий из тугоплавких соединений. М.,.Изд-во ВИНИТИ АН СССР и ГНТК, I960.
- В. С. Нешпор, Г. В. Самсонов. ДАН СССР, 133, 317 (1960).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'