
Состав окислов празеодима и тербия (М.Н. Амброжий, Е.Ф. Лучникова)
Вопрос о составе окислов празеодима и тербия, несмотря на многочисленные исследования в этом направлении, до сих пор остается дискуссионным. Вначале, согласно исследованиям Вельсбаха [1], продукту темного цвета, получаемому при прокаливании на воздухе гидроокиси и некоторых солей празеодима, приписывали эмпирическую формулу Рr4O7. Впоследствии состав этих окислов стали выражать формулой Рr6О4 [2]. Прандтль и Хуттнер [3] высказали предположение, что в состав соединения входит Рr (V). Точка зрения о том, что одним из компонентов смешанного окисла Рг6Оц является окисел Рr2O5, нашла экспериментальное обоснование в последующей работе Прандтля и Ридера [4], в которой состав Рr6O4 формулируется как 2РR2O3 × Рr2O6 или празеодимат празеодима 2Рr3+[Рr5+O4] × Рr2O3. Марш [5], повторивший опыты Прандтля и Ридера, рассматривает Рr6О4 как Рr2O3×4РrO2, где максимальная валентность празеодима не превышает четырех. Однако и он допускает, что в отдельных случаях возможна более высокая степень окисления празеодима.
Бартхауэр и Пирс [6] приводят доказательство того, что продукт прокаливания оксалата празеодима на воздухе при 955° С имеет состав, выражаемый формулами Рr4O7,56, Рr6О9,20, Рr6O11,04, Pr7O2,88, т. е. приближается в этом случае к формуле Рr6О4. Прокаливание соли при 670 и 780° С, по утверждению тех же авторов, якобы, не влияет на состав окислов. Что же касается окислов тербия, то по аналогии с празеодимом темно-коричневому продукту, образованному после прокаливания его оксалата на воздухе, стали приписывать формулу Тb4O7. Однако подтверждающих это надежных экспериментальных данных долго не было.
Прандтль и Ридер [4] по количеству активного кислорода, содержащегося в темно-коричневой окиси тербия, полученной прокаливанием оксалата на воздухе, обнаружили, что состав последней близок к формуле Тb4O7 и представляет собой тербиат тербия Тb2Тb2O7 (или Тb2O3 × 2ТbO2). При нагревании до 330° С в течение нескольких часов в атмосфере кислорода под давлением 20 атм состав этой окиси может быть выражен формулой ТЬбОц; таким образом, он аналогичен Рr6О4, получаемой при разложении оксалата празеодима в обычных условиях на воздухе. По данным Симона и Эйринга [7], при 400° С и давлении кислорода 282 атм тербий образует TbO1,76, окисляясь в меньшей' степени, чем празеодим. Наоборот, при нагревании в кислороде до 300° С под давлением до 30 атм в присутствии окиси иттрия и отношении Тb2O3: Y2O3 = 1:5 тербий полностью окисляется до четырехвалентного, образуя тербиат иттрия состава Y2Tb2O7.
Двуокиси празеодима и тербия имеют кристаллическую решетку флюоритового типа, в то время как их полуторные окиси - гексагональную решетку типа А [8]. Это различие в структуре, по-видимому, затрудняет полный переход соответствующих трехокисей в двуокиси в обычных условиях. Несмотря на многочисленные исследования, вопрос о получении чистых РrO2 и TbO2 до сих пор нельзя считать полностью разрешенным.
Цель настоящего исследования - выяснить состав окислов празеодима и тербия, образующихся в результате термического разложения солей, в зависимости от природы последних и температуры.
Были использованы результаты наших предыдущих исследований по качественному обнаружению высших окислов празеодима и тербия в присутствии их полуторных окислов [9, 10], а также данные по термо-графическому изучению нитратов, оксалатов, карбонатов и других солей рзэ цериевой подгруппы [11 -13]. Количественное определение РrO2 в сумме его полуторных окислов производили разработанным нами ранее химическим методом [14]. В связи с тем, что Тb2, подобно РrO2, характеризуется довольно сильными окислительными свойствами, она окисляет ионы Мn2+ в сернокислой среде до МnO4 по такой схеме:
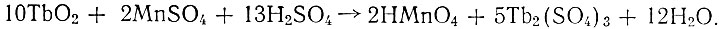 (1)
(1)Согласно данной реакции, можно по количеству образующейся марганцевой кислоты, определяемой титрованием щавелевой кислотой, косвенно установить содержание ТbO2, исходя из реакции
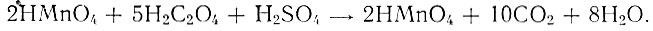 (2)
(2)20 мг каждого из полученных окислов тербия, как и в случае РrO2, помещали в стакан для титрования, приливали 4 мл раствора MnS04 (50 мг MnSO4/ мг) и 12 мл 9 N H2S04, не содержащей окислов азота. Для титрования образующейся по уравнению (1) НМnO4 применяли 0,01 N Н2С2O4, титр которой определяли по КМnO4.
Исходными продуктами для получения окисей празеодима и тербия служили синтезированные нами спектрально-чистые оксалаты и нитраты этих элементов. При выборе температуры разложения указанных солей с целью установления состава образующихся окислов исходили из данных термограмм, полученных на пирометре Курнакова [15]. Для расшифровки термограмм и определения природы образующихся продуктов термической диссоциации каждую из солей прокаливали 'в платиновой лодочке в трубчатой печи типа Марса с пропусканием воздуха. Температуру нагревания определяли при помощи платина-платинородиевой термопары. Каждый образец прокаливали при определенной температуре 15 мин., после чего лодочку охлаждали в эксикаторе, взвешивали на микровесах, а затем производили химический анализ данного продукта.
На рис. 1 приведена кривая нагревания Рr2 (С2O4)3 * 10Н2O, на которой отражен постепенный ход дегидратации, заканчивающийся при 280° С. Экзотермический эффект при 380° С связан с карбонизацией оксалата по схеме
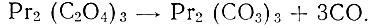
Наблюдаемый при 423° С эндотермический эффект относится, по-видимому, к первой стадии разложения карбоната Рr2(С03)3 → Рr2O3 + 3СO2, заканчивающейся при 500° С. Экзотермический эффект при 550° С связан с частичным образованием РrO2 (образец становится коричневым); при 750° С продукт окрашивается в черный цвет, а содержание РrO2 в нем повышается до 24,28%.
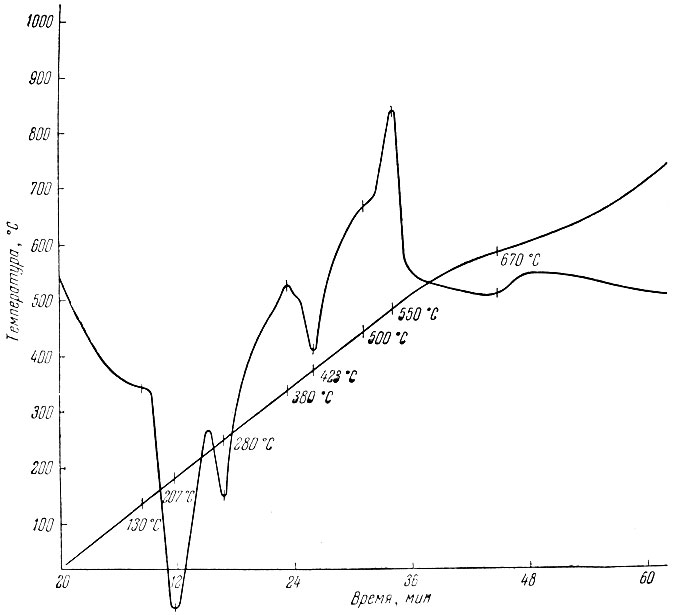
Рис. 1. Термограмма разложения Pr2(C2O4)×10H2O
Данные о количественном составе образующихся окислов приведены в табл. 1.
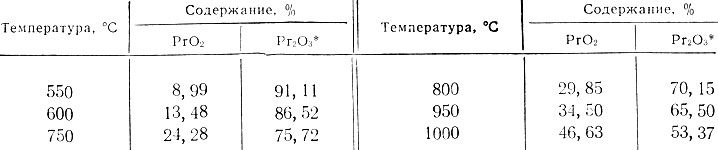
Таблица 1. Зависимость состава окислов празеодима, образующихся при прокаливании оксалата, от температуры
* (Количество Рr2О3 устанавливали по разности между общим весом окислов и определяемым весовым количеством РrО2.)
Из приведенных данных видно, что состав окислов, полученных при термическом разложении оксалата, изменяется в зависимости от температуры. Отсюда следует, что состав этих окислов нельзя выражать какой-либо определенной эмпирической формулой, вопреки имеющимся в литературе утверждениям о том, что при прокаливании оксалата на воздухе образуется окисел состава Рr6О4 [2, 8].
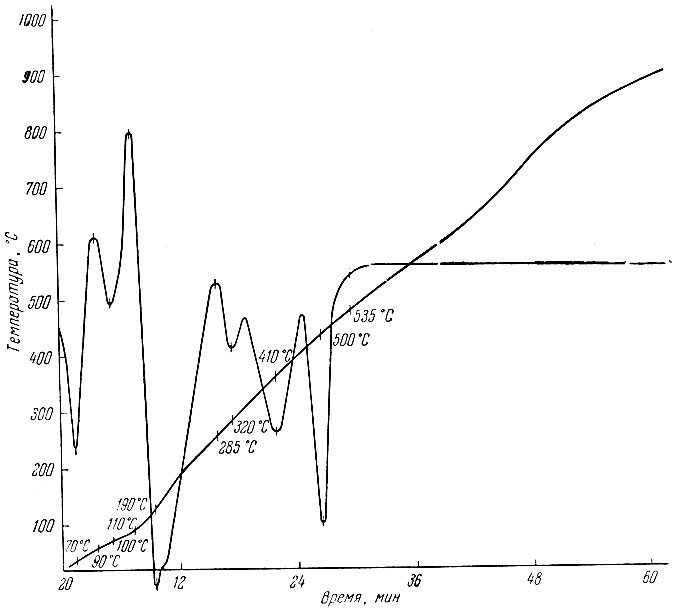
Рис. 2. Термограмма разложения Рr(NO3)3×6Н2O
Если выразить состав высшего окисла празеодима как Рr6О4 или Рr2O3 × 4РrO2 [5], то теоретически рассчитанное содержание РrO2 должно было бы составлять 67,72%. Однако это противоречит полученным нами экспериментальным данным. Если же состав этих окислов выразить как Рr2О3 × РrO2, то теоретически рассчитанное содержание в этом случае РrO2 составит 34,4%, что близко экспериментально найденному содержанию РrO2 при 950° С.
Аналогичная картина наблюдается также в результате проведенных опытов термического разложения нитрата празеодима. Как видно из термограммы (рис. 2), в случае нагревания Рr(NO3)3 × 6Н2O при 70- 410° С происходит постепенное удаление воды, зафиксированное на кривой рядом эндотермических процессов. Перемежающиеся кривые между заметными экзотермическими эффектами связаны, по-видимому, с процессами плавления, и затем - затвердевания. При 410° С соль теряет всю кристаллизационную воду, а при 450° С обнаруживается основная соль, которая при 500° С полностью разлагается с образованием смеси окислов Рr2O3 и РrO2. Этот процесс можно выразить следующей схемой:
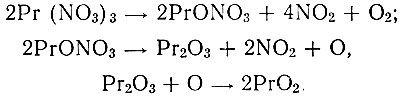
Заметное разложение нитрата было обнаружено, начиная с 500° С. В этих условиях цвет твердого продукта стал темно-коричневым; реакция на двуокись положительная. При 900° С цвет прокаленного продукта оставался без изменения, хотя содержание РrO2 увеличилось до 54%. Нагревание до 1000° С не вызывало существенного изменения количества образовавшейся РrO2. Результаты прокаливания нитрата празеодима приведены в табл. 2.
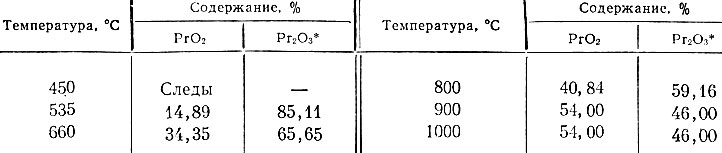
Таблица 2. Содержание окислов празеодима при прокаливании нитрата в зависимости от температуры
* (Количество Рr2О3 устанавливали по разности между общим весом суммы окислов и определяемым весовым количеством РrO2.)
Сравнивая результаты, полученные при термической диссоциации исследуемых солей празеодима, можно констатировать, что состав его окислов, как конечных продуктов разложения, не может быть выражен одной какой-либо формулой, поскольку соотношение РrO2 и Рr2O3 меняется в зависимости от природы исходных солей и температуры нагревания. По-видимому, на состав окислов празеодима, образующихся при термическом разложении его солей, существенное влияние оказывают выделяющиеся газообразные продукты.
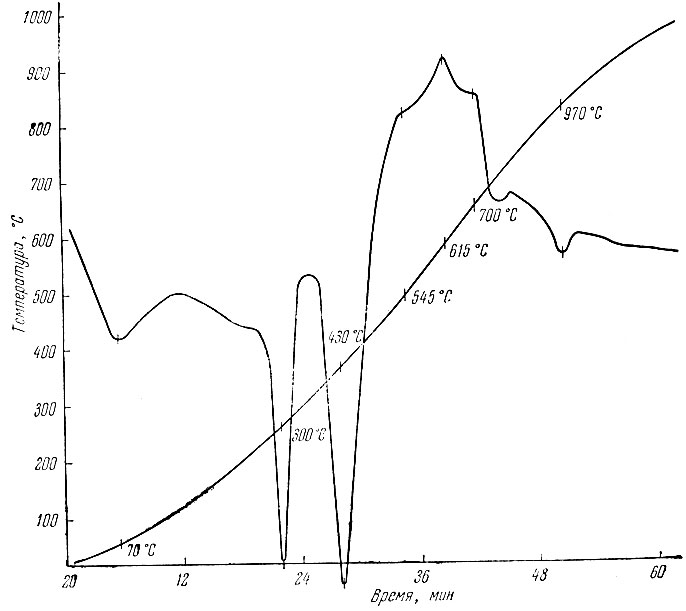
Рис. 3. Термограмма разложения Тb2(C2O4)3×10H2O
Термическое разложение оксалата и нитрата тербия изучали по методике, уже описанной для празеодима.
Как видно из термограммы разложения Тb2(С2O4)3× 10Н2O (рис. 3), экзотермическому эффекту при 300° С соответствует полная дегидратация кристаллогидрата, за которой следует разложение безводной соли. В отличие от оксалата празеодима процесс карбонизации здесь не наблюдался и при 430° С в продукте разложения коричневого цвета обнаружены ТbO2 и Тb2O3. По мере повышения температуры количество Тb2 увеличивалось, достигая максимума при ∼700°С. Затем содержание ТЬ02 начинало уменьшаться и при 1000° С стало равным 46,63%. Данные, характеризующие содержание окислов тербия при прокаливании оксалата, приведены в табл. 3.
Кривые нагревания нитрата тербия представлены на рис. 4. Первые три эндотермических эффекта соответствуют обезвоживанию продукта, при 230° С происходит плавление, а при 310° С - начало разложения соли; эндотермический эффект при 350° С, видимо, соответствует окислению образовавшейся Тb2O3. Начиная с 900° С, количество ТbO2 уменьшается, а при 1030° С становится равным 33,56%. Содержание окислов тербия при прокаливании нитратов в зависимости от температуры показано в табл. 4.
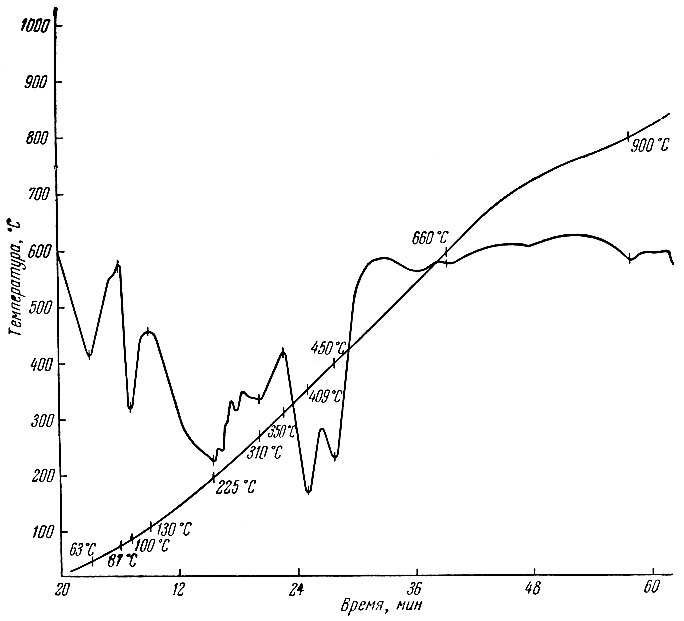
Рис. 4. Термограмма разложения Тb(NO3)3×6Н2O
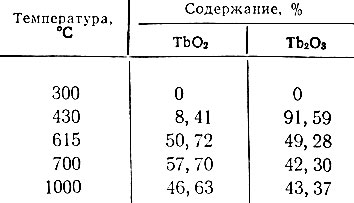
Таблица 3. Содержание окислов тербия при прокаливании оксалата в зависимости от температуры
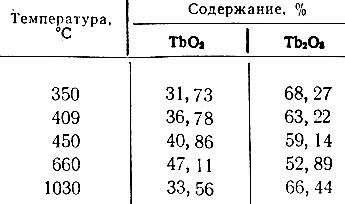
Таблица 4. Содержание окислов тербия при прокаливании нитрата в зависимости от температуры
Из приведенных данных следует, что состав окислов тербия, полученных при термическом разложении его оксалатов или нитратов, изменяется в зависимости от природы исходных солей и температуры нагревания; поэтому выразить их в виде какой-либо определенной химической формулы (например, Тb4O7, как указывается в литературе) не представляется возможным.
Таким образом, при химическом анализе солей или гидроокисей празеодима и тербия, а также расчетах следует исходить не из общих формул Рr6О4 и Tb4O7, а из фактического состава окислов, определяемого в данных конкретных условиях.
Литература
- A. von Wei sb a ch. Monatsh., 5, 508 (1884).
- Д. Иост, Г. Рэссел, К. Гарнер. Редкоземельные элементы и их соединения. Перевод с англ. под ред. Д. И. Рябчикова. М., ИЛ, 1949, стр. 41.
- W. Prandtl, К. Huttner. Z. anorg. Chem., 149, 235 (1925).
- W. Prandtl, G. Rieder. Z. anorg. Chem., 235, 225 (1938).
- I. K. Marsh. J. Chem. Soc., 1946, 15.
- G. L. Barthauer, D. W. Pearce. Ind. Eng. Chem., Anal. Ed., 18, 480 (1946).
- W. Simon, L. Eуring. J. Am. Chem. Soc., 76, 5874 (1954).
- В. В. Серебренников. Химия редкоземельных элементов. Изд. Томского ун-та, 1954, стр. 245, 248.
- М. Н. Aмброжий, Л. М. Кульберг, А. Т. Федоров а. Уч. зап. Саратовск. ун-та, 3, 149 (1956).
- М. Н. Амброжий. Сб. "Редкоземельные элементы". М., Изд-во АН СССР, 1958, стр. 179.
- М. Н. Амброжий, Е. Ф. Лучникова, М. И. Ииколаевская, Л. А. Павлова, Ю. А. Осипова. Второе совещание по термографии. Тезисы докладов. Изд-во Казанского филиала АН СССР, 1957, стр. 34.
- М. И. Амброжий, Ю. А. Осипова. ЖНХ, 3, 113 (1958).
- М. И. Амброжий, Е. Ф. Лучникова. ЖНХ, 5, 366 (1960).
- М. H. Амброжий, А. М. Гольцев. Научные доклады Высшей школы. Химия и хим. технология, № 3, 491 (1958).
- Л. Г. Берг. Введение в термографию. М., Изд-во АН СССР, 1961, стр. 22.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'