
Высшие окислы празеодима и тербия и возможности их количественного определения в смесях редкоземельных элементов (Г.Я. Горный)
Для разработки метода количественного определения празеодима было использовано свойство гидроокиси, карбоната,- нитрата, оксалата и некоторых других его соединений переходить при прокаливании на воздухе в высший окисел, трактуемый как празеодимат празеодима Рr2O5 × 2Рr2O3 ИЛИ Рr6О4 [11], по другим данным - РrO2 [2]. Амброжий и Гольцев* [3] с этой целью предложили применять реакцию окисления Мn2+ активным кислородом окисла празеодима:
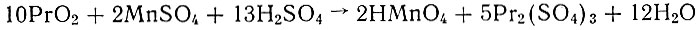
с последующим титрованием образующейся НМnO4 щавелевой кислотой. Однако в рекомендуемых ими условиях реакция до конца не идет, что приводит к ошибочной формулировке состава высших окислов празеодима, полученных при прокаливании нитрата и оксалата празеодима, а именно Рr2O3-2РrO2 (Рr4O7) и Рr2O3×РrO2 (Рr3O5).
* (Работа была начата и почти завершена до опубликования статьи Амброжия и Гольцев а [3].)
Как выяснилось при проведении настоящего исследования, состав высшего окисла празеодима зависит от относительного содержания празеодима в смеси, ее состава (наиболее благоприятные условия создаются в смеси Рr и Nd), природы анионов, связанных с рзэ, температуры и других условий прокаливания. При разработке метода количественного определения празеодима была использована реакция выделения иода в кислом растворе иодида калия.
Для определения празеодима в смеси рзэ цериевой подгруппы образец нитрата медленно нагревают до 700° С и выдерживают при этой температуре 2 часа. Полученный высший окисел празеодима растворяют в подкисленном растворе KJ в атмосфере СO2 (в темноте) при периодическом взбалтывании, выделившийся иод титруют раствором Na2S2O3.
В связи с тем, что в этих же условиях церий будет присутствовать в виде двуокиси, а тербий переходит в высший окисел, определению празеодима должно предшествовать предварительное выделение церия и раз-деление суммы рзэ на цериевую и иттриевую подгруппы.
Побочная реакция выделения иода происходящая в результате взаимодействия кислорода воздуха или кислорода, растворенного в жидкости, с кислым раствором KJ (особенно на свету и при нагревании), в рекомендуемых условиях сведена к минимуму.
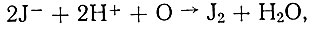
Указанный метод вначале был проверен на препарате Окиси празеодима. Было установлено, что прокаливание оксалата и нитрата празеодима при постепенном повышении температуры до 700° С и дальнейшем прокаливании при этой же температуре в течение 2 час. приводит к получению высшего окисла состава Рr6О4. Формула была выведена, исходя из количества выделяющегося при реакции иода. При прокаливании гидроокиси в этих условиях получают заниженные результаты.
В табл. 1 приведены результаты определения Рr6О4 в исходной окиси празеодима.
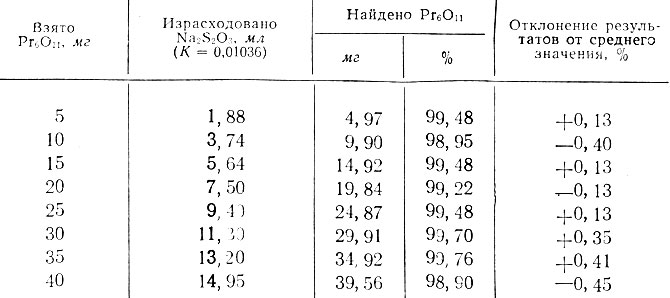
Таблица 1. Результаты иодометрического определения Рr6О4 в препарате окиси празеодима
Как видно, ошибка определения не превышает обычной ошибки опыта, максимальное отклонение результатов от среднего значения составляет -0,45% и может быть уменьшено, если пользоваться более разбавленным раствором Na2S2O3.
Условия прокаливания образцов, содержащих смесь оксалатов неодима и празеодима, играют особо важную роль: необходимо прокаливать пробу при доступе воздуха, постепенно повышая температуру до 700° С и выдерживать при этой же температуре в течение 2 час., в противном случае Рr6О4 разлагается (при более высокой температуре - почти до полуторной окиси). К такому же выводу приходят и другие авторы [4] на основании результатов тонких измерений объема непрочно связанного кислорода, выделяющегося по реакции
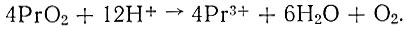
По их данным, при содержании в смеси 10 мол. % празеодима формула его становится Pr5O2 (цвет окиси изменяется, вместо бурой - слегка буроватая).
В табл. 2 приведены результаты определения празеодима в смесях с неодимом в широком интервале концентраций, а также данные о влиянии температуры.
Из табл. 2 видно, что процесс окисления празеодима в смесях с неодимом зависит от соотношения компонентов смеси и температуры прокаливания. Удовлетворительная воспроизводимость результатов получается при 700° С (для оксалатов). При более высокой температуре, особенно при малом содержании празеодима в смеси, высший его окисел разлагается. При содержании в смеси до 10-12% окисла празеодима окисление идет до РrO2; при содержании от 11 до 60% - до РrO1,52, при большем содержании празеодима в смеси образуется Рr6О4. Влияние других рзэ на окисление празеодима в смесях окислов, полученных при прокаливании оксалатов, показано в табл. 3.
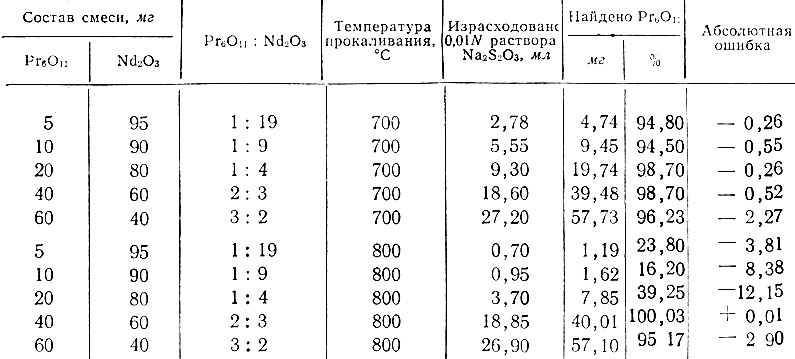
Таблица 2. Результаты определения празеодима в смесях с неодимом

Таблица 3. Определение празеодима в смесях с рзэ цериевой подгруппы (при прокаливании оксалатов)
* ( Обусловлено примесью Се.)
Учитывая изложенное, можно допустить, что при прокаливании оксалатов рзэ дальнейшее окисление образующейся окиси празеодима кислородом воздуха происходит как обратимый каталитический процесс:
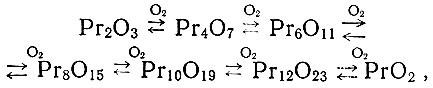
причем присутствие Nd оказывает каталитическое действие на образование высшего окисла празеодима, La и Sm - низшего. Этот процесс - также функция температуры.?
Была сделана попытка устранить это препятствие, используя для окисления празеодима кислород в момент выделения в отсутствие мешающих окислению веществ, например СО. и СO2, образующихся при разложении оксалатов рзэ. В качестве исходных веществ целесообразнее использовать нитраты, разлагающиеся при нагревании по схеме
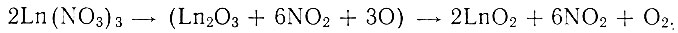
Нитраты не окисляющихся рзэ смеси являются в этом случае резервом кислорода, и тем большим, чем меньше празеодима содержится в смеси.
Определение выполняется следующим образом. Из суммы рзэ предварительно удаляют Се иодатным [5] или броматным [6] методами или по одному из их вариантов [7, 8]. Рзэ выделяют в виде оксалатов и прокаливают при невысокой температуре. Окись растворяют в HNO3 (1:1) в фарфоровом тигле, в котором производили прокаливание, раствор выпаривают досуха*. Образовавшийся нитрат медленно нагревают до 700° С, продолжают прокаливание при этой температуре (2 часа) и доступе воздуха. Сумму окислов рзэ взвешивают и вместе с тиглем помещают в широкогорлую колбу емкостью 300 мл с пришлифованной пробкой. Наливают 20 мл 0,2 N раствора KJ, пропускают в течение 5 мин. ток СO2 из баллона, приливают 20 мл НСl (1 : 1), плотно закрывают колбу пробкой и ставят в темное место на 1-2 часа при периодическом перемешивании магнитной мешалкой до полного растворения навески. Приливают 150-200 мл воды, выделившийся иод титруют 0,005 N раствором Na2S2O3 в присутствии крахмала. На контрольное определение в этих условиях, как правило, затрачивается не более 0,15-0,20 мл 0,005 N раствора Na2S2O3. Формулу высшего окисла празеодима (PrO2, Pr10O19 или Рr6О11) устанавливают, исходя из объема раствора Na2S2O3, израсходованного на титрование, согласно данным, приведенным в табл. 2 (с учетом взятой навески).
Метод был применен для определения празеодима в сумме рзэ, выделенных из монацита. При этом найдено 5,32% Рr6О4; по данным микро-объемного определения, после хроматографического выделения празеодима - 5,24% [9].
* (Если присутствует тербий, то предварительно разделяют сумму рзэ на цериевую и иттриевую подгруппы.)
В табл.4 приведены результаты определения празеодима в присутствии рзэ цериевой подгруппы в смесях окислов, полученных при прокаливании нитратов.

Таблица 4. Определение празеодима в смесях с рзэ цериевой подгруппы (при прокаливании нитратов)
* (Поправки на содержание празеодима в окислах не вводили.)
Аналогичное исследование было произведено с препаратом тербия и смесями его с иттрием. Как оказалось, формула высшего окисла тербия соответствует Тb4O7, что совпадает с литературными данными [10]. Результаты определения Тb4O7 в окиси тербия приведены в табл. 5. Как видно, воспроизводимость метода достаточно удовлетворительна.
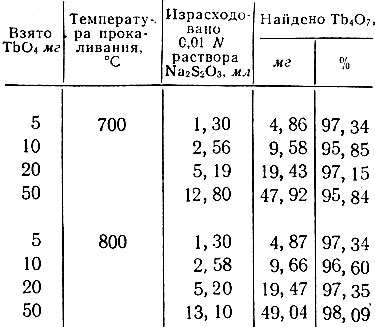
Таблица 5. Результаты иодометрического определения Tb4O7 в окиси тербия
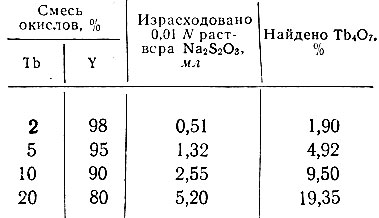
Таблица 6. Результаты иодометрического определения Tb4O7 в смесях тербия с иттрием
Прокаливание оксалатов смесей и других рзэ следует производить медленно, сначала при 450 С (эту температуру поддерживают до полного озоления осадка) и доступе воздуха. При этом удаляются мешающие окислению СО и СO2. Затем температуру повышают до 500° С и прокаливают 5-6 час. до постоянного веса. Результаты опытов приведены в табл. 6.
Для повышения точности определений необходимо применять микротитрование (особенно при малых навесках) и пользоваться более разбавленными растворами Na2S2O3.
Сопоставляя полученные данные с результатами определения тербия в его препарате, наблюдаем удовлетворительное совпадение. Это позволяет сделать вывод о том, что в смесях тербия с иттрием в принятых условиях образуется Тb4O7.
Литература
- W. Prandtl, G. Riеdеr. Z. anorg. Chem., 238, 225 (1938).
- I. Маrsh. J. Chem. Soc., 1946. 15.
- М. H. Амброжий, А. М. Гольцев. Научные доклады Высшей школы. Химия и хим. технология, № 3, 491 (1958).
- L. Wolf, G. Wolf, Н. Ваrnighausеn. J. Pract. Chem., 6, 259 (1958).
- Р. Н. Вrintоn, С. James, J. Chem. Soc., 41, 1080 (1919); Z. anal. Chem., 60, 50 (1921); Анализ минерального сырья. Сборник методов химического анализа. Л., ОНТИ, Химтеорет, 1936, стр. 140.
- С. James, J. Н. Pratt. J. Am. Chem. Soc., 33, 1326 (1911); В. P. Шеллер, A. P. Поуэлл. Анализ минералов и руд, содержащих редкие элементы. Л., НХТИ, 1928, стр. 72.
- Ю. А. Чернихов, Т. А. Успенская. Зав. лаб., 9, 277 (1940).
- Э. А. Остроумов. ЖАХ, 2, 111 (1947).
- Н. С. Полуэктов, Р. С. Лауэр, Р. Я. Ягнятинская. Сб. "Редкоземельные элементы". М., Изд-во АН СССР, 1958, стр. 199.
- Д. Иост, Г. Рэссель, К. Гарнер. Редкоземельные элементы и их соединения. Перевод с англ. под ред. Д. И. Рябчикова. М., ИЛ, 1949, стр. 42.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'