
Исследование реакций образования гидроокисей лантана и церия (Н.Н. Миронов, Н.П. Черняев)
Методы получения гидроокисей и основных солей металлов описаны довольно подробно [1-7], однако физико-химические исследования состава гидроокисей металлов в зависимости от условий осаждения весьма немногочисленны [8].
Настоящая работа ставит цель - изучить реакции образования гидроокисей лантана и церия методами физико-химического анализа (растворимости, измерения pH, электропроводности и объема осадков, потенциометрического и кондуктометрического титрования).
Образование гидроокиси церия
Изучение влияния аниона соли и концентрации исходного раствора на процесс образования гидроокиси церия в сернокислых, солянокислых и азотнокислых растворах проводили в атмосфере азота и воздуха. Изучали влияние кислорода воздуха, так как в щелочной среде в его присутствии легко происходит процесс окисления Се3+ → Се4+.
Результаты исследования системы Ce2(S04)3- NaOH - Н20 методом растворимости представлены на рис. 1-4 и в табл. 1-4. Как видно, выделению гидроокиси предшествует образование основных солей. Для системы с содержанием 0,04 г-иона Се/л до молярного отношения ОН-:Се3+= 0,5 образуется основная соль состава Ce(OH)SO4. Дальнейшее увеличение количества щелочи приводит к превращению ее в основную соль состава Ce4(OH)3(SO4)3 с n - 0,75 (где n - молярное отношение ОН- : Се3+ в исходной смеси). При n = 2,0 образуется основная соль Ce2(OH)4SO4, в виде которой и заканчивается осаждение церия из раствора. Дальнейшее увеличение содержания щелочи в смеси приводит к взаимодействию осадка основной соли с раствором щелочи. Соединение Ce2(OH)4SO4 под действием щелочи превращается при n = 2,5 в основную соль. Последняя переходит в гидроокись церия. Ионы гидроксила появляются в растворе раньше, чем было добавлено 3 экв. щелочи на 1 г-ион Се. Это свидетельствует о том, что сульфат-ионы основной соли Ce4(OH)10SO4 с трудом замещаются ОН-ионами. Гидроксильные ионы не захватываются осадком гидроокиси церия. Чистая гидроокись церия может быть получена при значительном избытке щелочи.
Механизм процесса, образования основных солей указанного состава и гидроокиси церия подтверждается данными измерения pH и электропроводности равновесных растворов (рис. 5), а также потенциометрическим и кондуктометрическим титрованием раствора сульфата церия едким натром и измерением кажущегося объема осадков [9, 10].
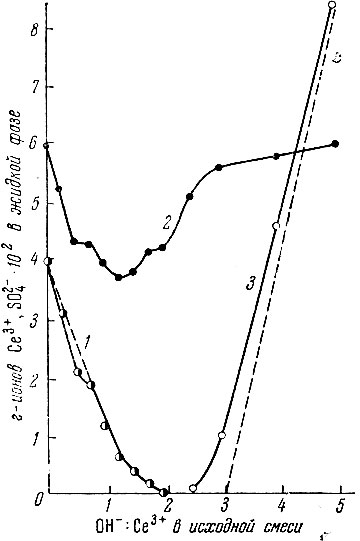
Рис. 1. Изменение состава жидкой фазы в системе Ce2(SO4)3 - NaOH - H2O в атмосфере азота при содержании 4×10-2 г-ионов Ce3+/л 1 - Ce3+; 2 - SO2-4; 3 - OH-;
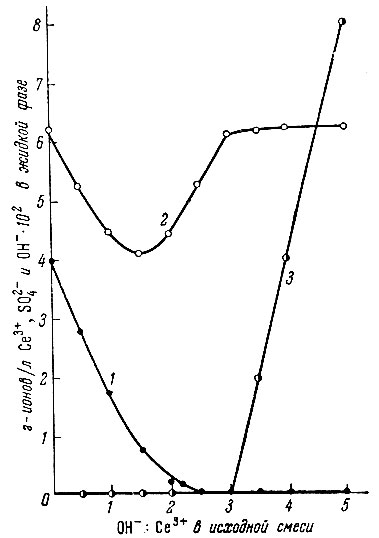
Рис. 2. Изменение состава жидкой фазы в системе Ce2(SO4)3 - NaOH - H2O в атмосфере воздуха при содержании 4×10-2 г-ионов Ce3+/л 1 - Ce3+; 2 - SO2-4; 3 - OH-;
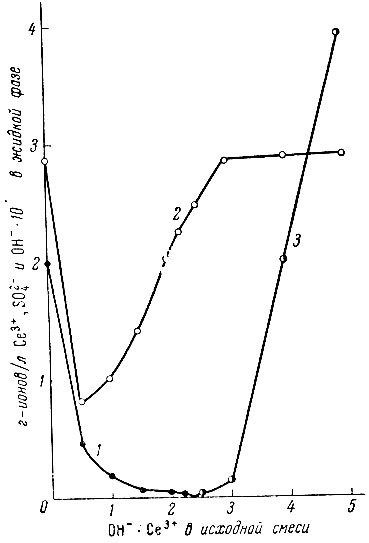
Рис. 3. Изменение состава жидкой фазы в системе Ce2(SO4)3 - NaOH - H2O при содержании 2×10-1 г-ионов Ce3+/л 1 - Ce3+; 2 - SO2-4; 3 - OH-;
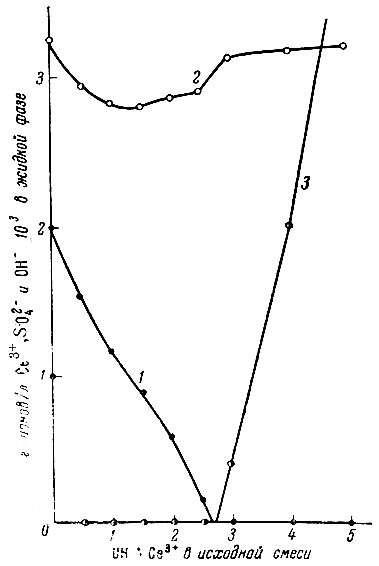
Рис. 4. Изменение состава жидкой фазы в системе Ce2(SO4)3 - NaOH - H2O при содержании 2×10-3 г-ионов Ce3+/л 1 - Ce3+; 2 - SO2-4; 3 - OH-;
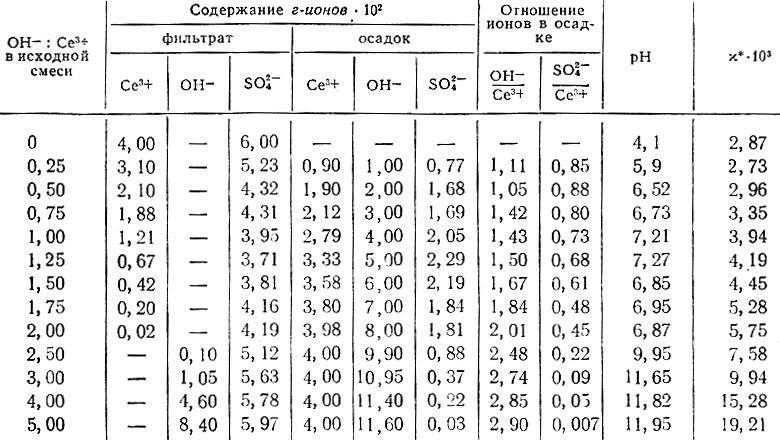
Таблица 1. Данные о растворимости в системе Ce2(S04)3 - NaOH - H2O в атмосфере азота
* (χ - удельная электропроводность. )
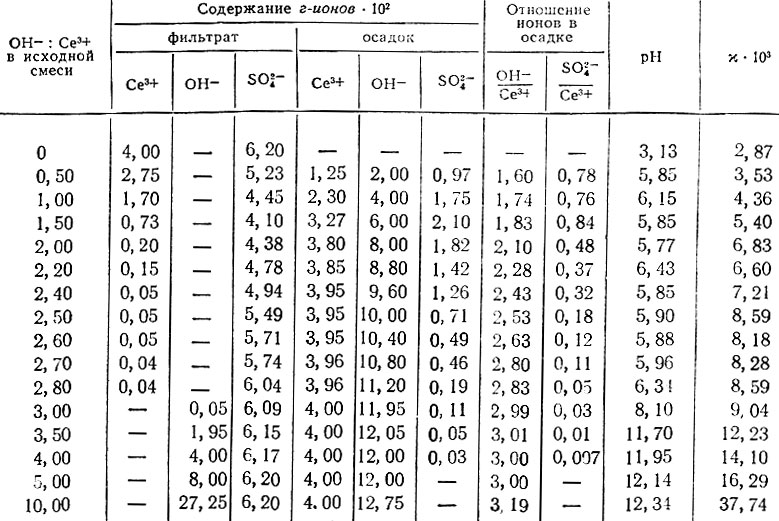
Таблица 2. Данные о растворимости в системе Ce2(SO4)3 - NaOH - H2O в атмосфере воздуха при 25° С
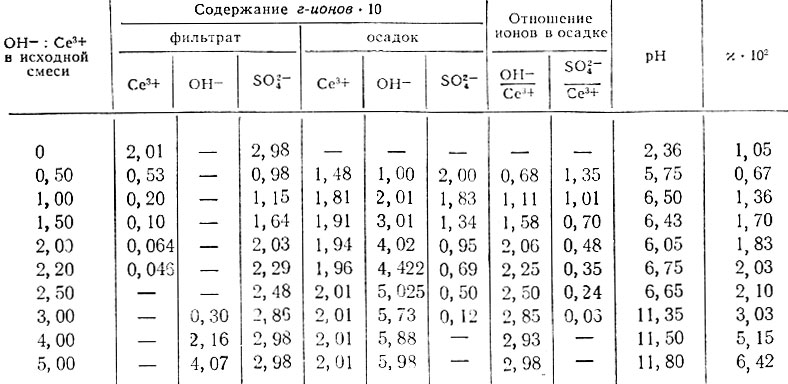
Таблица 3. Данные о растворимости в системе Се2(SO4)3 - NaOH - H2O
На кривой изменения pH наблюдается ярко выраженный перегиб при n = 2,0, что соответствует образованию основной соли состава Ce2(OH)4S04. Образование этой же соли отмечается и на кривой изменения электропроводности резким изломом при n = 2,0. Незначительные изломы наблюдаются при n = 0,5; 1,0; 1,5 и 3,0.
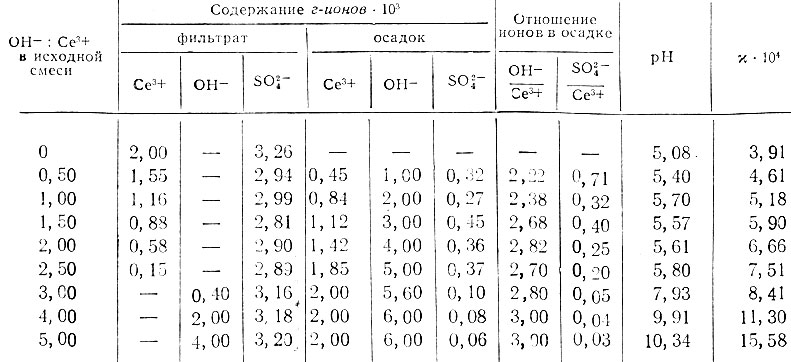
Таблица 4. Данные о растворимости в системе Се2(SO4)3 - NaOH - H2O
Из табл. 2 и рис. 2 видно, что кислород воздуха оказывает существенное влияние на процесс образования и осаждения гидроокиси церия из сернокислых растворов. Образующиеся при добавлении щелочи к раствору соли церия осадки, начиная с n = 1,0, окрашены в светло- розовый цвет, который при n = 3,0 становится темно-фиолетовым. Если n > 3,0, то осадок приобретает желтый цвет, который характерен для гидроокиси Се (IV). Изменение окраски осадков свидетельствует о том, что в системе происходит процесс частичного окисления церия под действием кислорода воздуха. Осадки основных солей имеют следующий состав.

Из этих примеров видно, что с увеличением молярного отношения ОН-:Се3+ процесс окисления Се3+ → Се4+ усиливается.
Влияние концентрации исходных растворов на процесс образования и осаждения гидроокиси церия видно из данных табл. 1, 3, 4 и рис. 1, 3, 4.
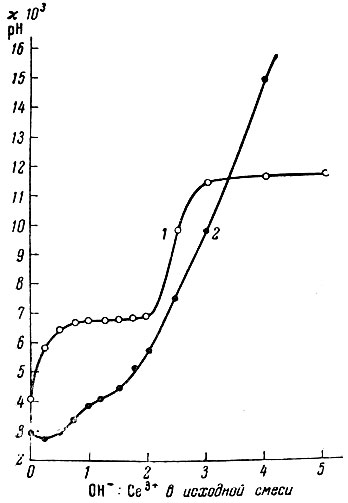
Рис. 5. Изменение удельной электропроводности и pH в системе Ce2(SO4)3 - NaOH - H2O при 25°С. 1 - pH; 2 - электропроводность
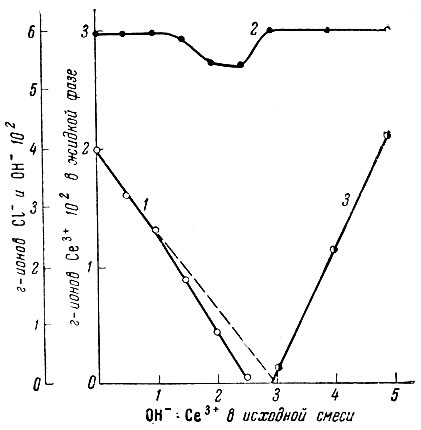
Рис. 6. Изменение состава жидкости фазы в системе CeCl3 - NaOH - H2O. 1 - Ce3+; 2 - Cl-; 3 - OH-
Из результатов, полученных методом растворимости, можно сделать вывод, что при осаждении гидроокиси церия из растворов различных концентраций всегда образуются основные соли, состав и устойчивость которых в значительной степени зависят от концентрации раствора. По мере разбавления раствора основные соли меняют свой состав, приближаясь к гидроокиси церия.
Результаты исследования системы СеСl3 - NaOH - Н2O методом растворимости представлены в табл. 5 и на рис. 6, кривые изменения pH и электропроводности равновесных растворов показаны на рис. 7. При добавлении к раствору соли первых порций щелочи появляется коллоидный осадок. В случае дальнейшего увеличения содержания NaOH в исходной смеси степень полимеризации основной соли увеличивается; она все больше выделяется в осадок, и при n = 2,5 осаждение церия из раствора заканчивается. Коллоидное состояние осадка характерно до n = 2,8. В осадок выделяется основная соль состава Се(ОН)2,5Сl0,5. Эта соль сравнительно неустойчива и легко разлагается при увеличении содержания щелочи в смеси от n = 2,5 до n = 3,0. Образование гидроокиси церия отмечается резким изломом на кривой изменения электропроводности раствора при n = 3,0. Потенциометрическим и кондуктометрическим титрованием фиксируется только образование гидроокиси церия при n = 3,0, что можно использовать для количественного определения церия.
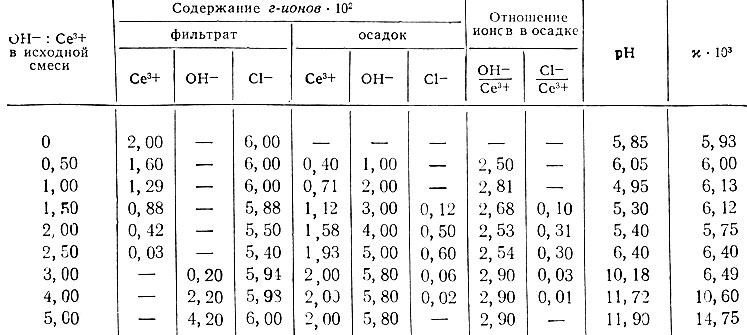
Таблица 5. Данные о растворимости в системе СеСl3 - NaOH - Н2O в атмосфере азота при 25° С
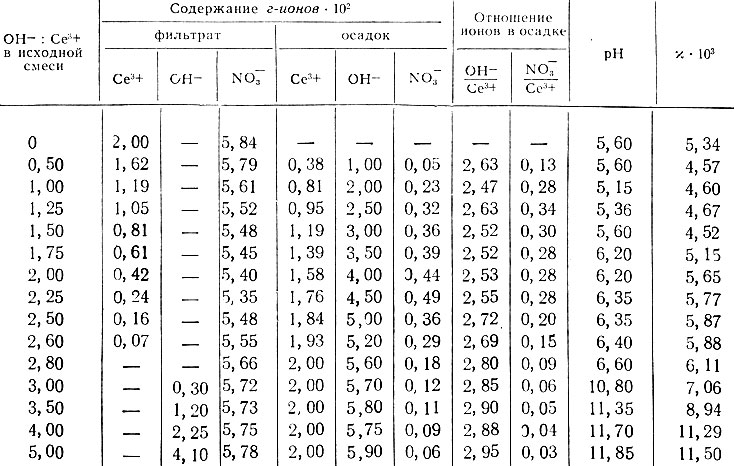
Таблица 6. Данные о растворимости в системе Ce(NO3)3- NaOH - Н2O в атмосфере азота
Результаты опытов по изучению системы Ce(NO3)3- NaOH - Н2O представлены на рис. 8 и приведены в табл. 6. После введения в раствор нитрата церия раствора NaOH наблюдалось образование коллоидов. Коллоидные осадки менее характерны, чем в случае реакции образования гидроокиси церия из растворов хлоридов. Они довольно легко коагулируют после центрифугирования и непродолжительного отстаивания. Очень сильное влияние на устойчивость коллоидных растворов оказывает кислород. Достаточно незначительного окисления церия, как коллоидный раствор коагулирует, и образующийся осадок хорошо оседает и легко отфильтровывается. Осадок до n = 2,5 представляет собой основную соль состава Ce(OH)2,5(NO3)0,5, переходящую при дальнейшем добавлении щелочи в основную соль состава Ce(OH)2,8(NO3)0,2, в виде которой и заканчивается осаждение церия из раствора. Последующее увеличение щелочи в системе приводит к переходу основной соли Ce(OH)2,8(NO3)0,2 в гидроокись церия. Потенциометрическим и кондуктометрическим титрованием фиксируется только образование гидроокиси церия.
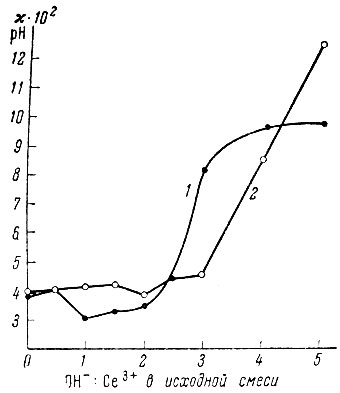
Рис. 7. Изменение удельной электропроводности pH в системе СеСl3 - NaOH - Н2O при 25° С. 1 - pH; 2 - электропроводность
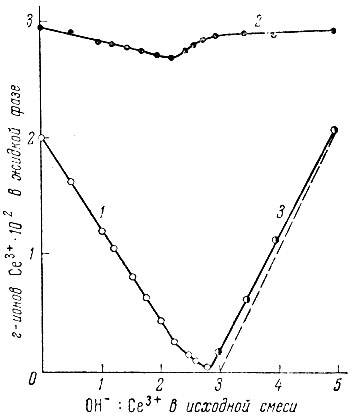
Рис. 8. Изменение удельной электропроводности в системе Се(NO3)3 - NaOH - Н2O при 25° С. 1 - Ce3+; 2 - NO-3; 3 - OH-
Образование гидроокиси лантана
Результаты изучения системы La2(S04)3 - NaOH - Н2O представлены на рис. 9-11 и приведены в табл. 7-9. Как видно, в зависимости от концентрации исходных растворов первоначально образующиеся основные соли имеют различный состав. Так, из растворов, содержащих 8×10-2 г-ионов La/л, образуется основная соль состава La(OH)SO4, которая при дальнейшем добавлении раствора NaOH переходит в основную соль состава La2(OH)4S04. Из растворов, содержащих 4×10-2 г-ионов La/л, вначале образуется основная соль состава La4(OH)6(SO4)3, которая затем переходит при n = 2,0 в основную соль La2(OH)4SO4 и при n = 2,5 - в La4(OH)10SO4 и La(OH)3. Из разбавленных растворов, содержащих 2- 10-3 г-ионов La/л, осаждение лантана происходит в виде .основной соли La2(OH)4S04, которая затем переходит в гидроокись.
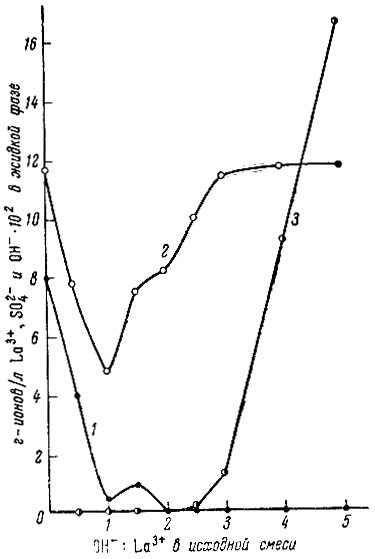
Рис. 9. Изменение состава жидкости фазы в системе La2(SO4)3 - NaOH - H2O при содержании 8×10-2 г-ионов La3+/л, 1 - La3+; 2 - SO2-4; 3 - OH-
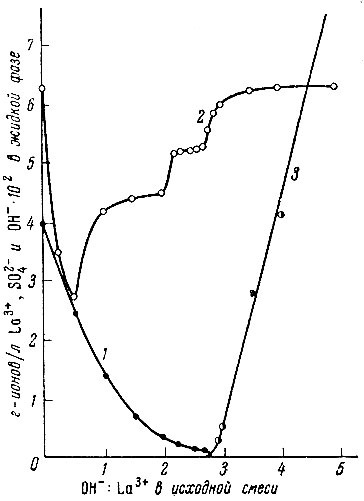
Рис. 10. Изменение состава жидкости фазы в системе La2(SO4)3 - NaOH - H2O при содержании 4×10-2 г-ионов La3+/л, 1 - La3+; 2 - SO2-4; 3 - OH-
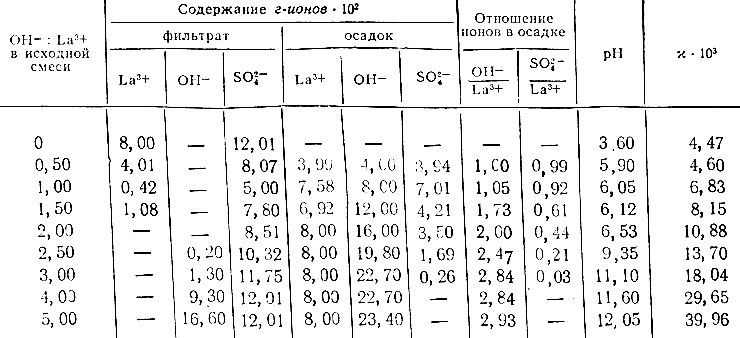
Таблица 7. Данные о растворимости в системе La2(SO4)3 - NaOH - Н2O
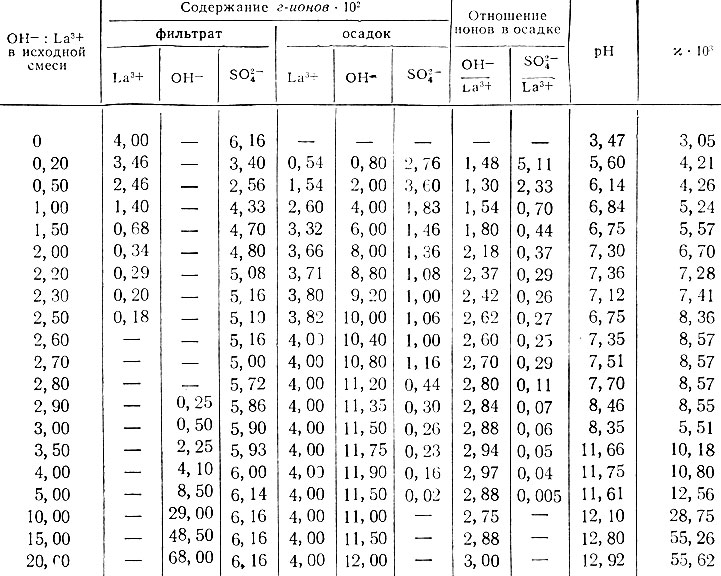
Таблица 8. Данные о растворимости в системе La2(S04)3 - NaOH - Н2O
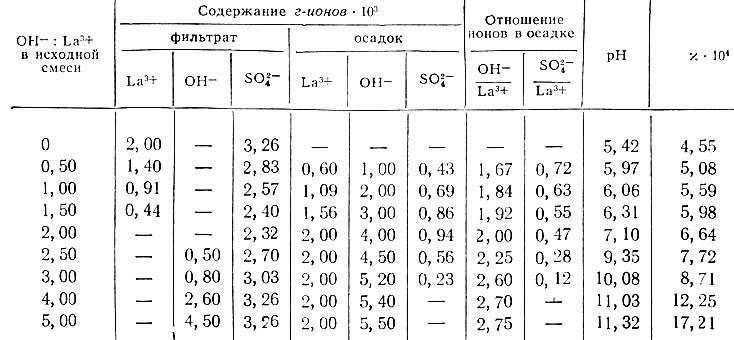
Таблица 9. Данные о растворимости в системе La2(S04)3 - NaOH - Н2O
Результаты, полученные методом растворимости, в значительной степени подтверждаются данными измерения pH и электропроводности в равновесных растворах, а также потенциометрическим и кондуктометрическим титрованием и измерением кажущегося объема осадков [9, 10].
Данные по изучению системы LaCl3 - NaOH - Н2O методом растворимости представлены на рис. 12 и приведены в табл. 10. При добавлении первых порций NaOH к раствору LaCl3 сначала появляется небольшая муть коллоидного характера, дальнейшее повышение содержания щелочи в исходной смеси приводит к увеличению степени полимеризации основной соли, она все в больших количествах выделяется в осадок. До n = 2,8 коллоидный раствор устойчив. Коагуляция не наблюдалась при добавлении электролита, быстром замораживании и оттаивании. Коллоидный раствор проходил, не осветляясь, через несколько плотных бумажных фильтров и не коагулировал при стоянии в течение трех месяцев. Коагуляция наблюдалась при n = 2,8. Если n = 2,5, лантан количественно находился в осадке; при этом же отношении наблюдается и минимальное содержание ионов хлора в растворе. Это явление объясняется образованием малоустойчивой основной соли La(OH)2,5 С10,5, которая имеет коллоидный характер и легко превращается в гидроокись лантана при увеличении содержания NaOH в смеси. Образование La (OH)2,5C10,5 и La(OH)3 подтверждается результатами измерения pH и электропроводности в равновесных растворах (рис. 13).
Результаты исследования системы La(NO3)3 - NaOH - Н2O представлены на рис. 14 и в табл. 11. При взаимодействии La(NO3)3 с NaOH (NaOH : La3+ равно 0,2-2,8) также образуются осадки коллоидного характера. Коллоидные осадки, полученные при взаимодействии раствора La (N03)3 и NaOH, менее устойчивы и фильтруются гораздо лучше, чем коллоидные осадки, образующиеся при взаимодействии Lal3 с NaOH.
Из данных, полученных методом растворимости, видно, что в системе выделяется основная соль La(OH)2,6(NO3)0,4, которая при добавлении щелочи переходит в основную соль La(OH)2,8(NO3)0,2, превращающуюся затем в La(OH)3. Из кривых изменения pH и электропроводности равновесных растворов, представленных на рис. 15, следует, что в системе также образуются основные соли состава La(OH)2NO3 и La(OH)2,5NO0,5 и гидроокись лантана.
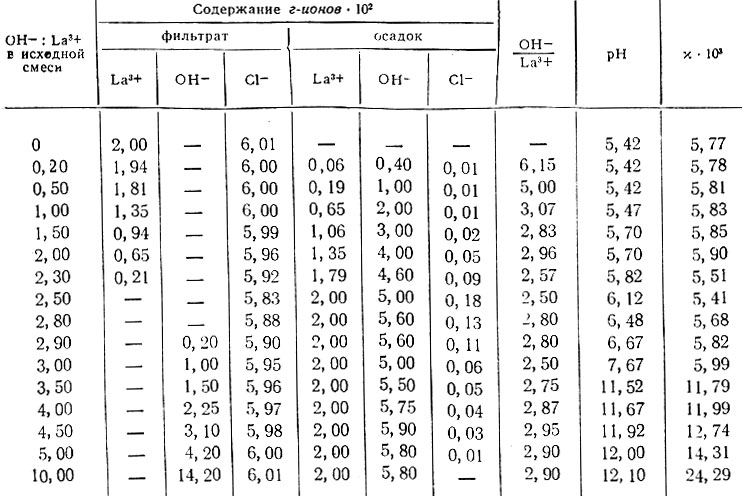
Таблица 10. Данные о растворимости в системе LaCl3 - NaOH - Н2O
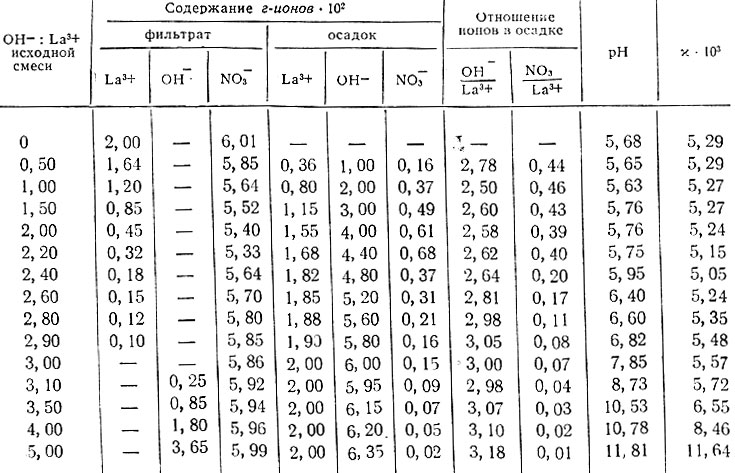
Таблица 11. Данные о растворимости в системе La(NO3)3 - NaOH - Н2O
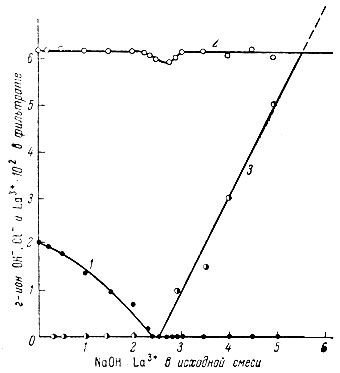
Рис. 12. Изменение состава жидкой фазы в системе LaCl3 - NaOH - H2O; 1 - La3+; 2 - Cl-; 3 - OH-
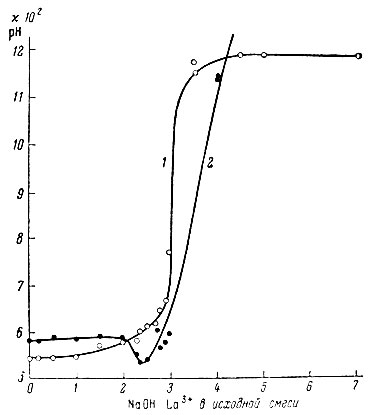
Рис. 13. Изменение удельной электропроводности и pH в системе LaCl3 - NaOH - H2O. 1 - pH; 2 - электропроводность
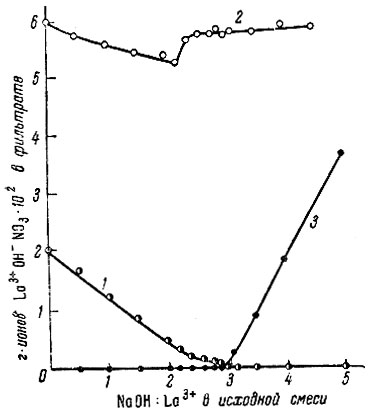
Рис. 14. Изменение состава жидкой фазы в системе La(NO3)3 - NaOH - Н2O. 1 - La3+; 2 - NO-3; 3 - ОН-
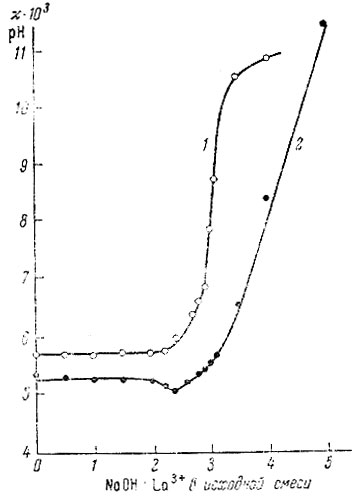
Рис. 15. Измерение удельной электропроводности и pH в системе La(NO3)3 - NaOH - H2O 1 - pH; 2 - электропроводность
Резкие изменения pH и электропроводности растворов при n = 3,0 можно использовать для количественного определения лантана в азотнокислых растворах.
Состав основных сульфатов церия и лантана подтвержден количественным анализом твердой фазы, а их индивидуальность рентгенофазовым и термографическими методами.
Литература
- Н. Т. S. Britton. J. Chem. Soc., 127, 2142 (1925).
- J. А. С. Boules, Н. М. Раrtridgе. Ind. Eng. Chem., Anal. Ed., 9, 127 (1937).
- J. Oka. J. Chem. Soc. Japan, 61, 311 (1940).
- Th. Moeller, H. E. Kremers. J. Phys. Chem., 48, 395 (1944).
- P. Kuen, H. T. Ming. Bull. Chem. Soc. Japan, 28, 309 (1955).
- H. В. Аксельруд, В. Б. Спиваковский. ЖНХ, 4, 56 (1959).
- И. В. Тананаев, М. Я. Бокмельдер. ЖНХ, 5, 701 (1960).
- И. В. Тананаев. Вестник АН СССР, № 9, 32 (1961).
- Н. Н. Миронов, Н. П. Черняев. Тр. по химии и хим. технологии (г. Горький), 3, 456, 464, 470 (1960).
- Н. Н. Миронов, Н. П. Черняев. ЖНХ, 6, 2163, 2180 (1961).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'