
Перекисные соединения редкоземельных элементов (С.З. Макаров, Л.В. Соболева)
Перекисные соединения рзэ известны с 1885 г. Их синтезировали из растворов солей, щелочи, а также из гидроокисей этих элементов и перекиси водорода [1-13]. Состав перекисных соединений рзэ выражали общей формулой Ln2O5×xH2O; в более поздних работах для них предлагается гидроперекисная структура типа Ln(OOH)(ОН)2×nН2O Церий (IV), а также элементы подгруппы титана образуют перекисные соединения состава ЭO3×2Н2O [14-20] или в гидроперекисной форме - Э(OOН)(OН)3-yН2O.
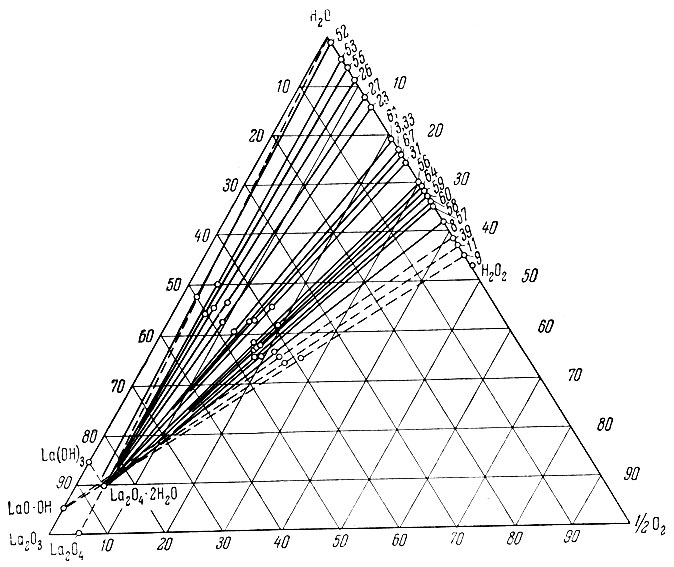
Рис. 1. Изотерма 0° С тройной системы La(ОН)3 - Н2О2 - Н2O
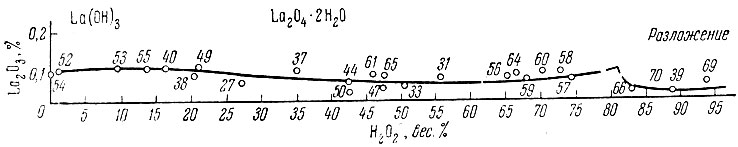
Рис. 2. Изотерма 0° С тройной системы La(ОН)3 - Н2О2 - Н2O в прямоугольных координатах
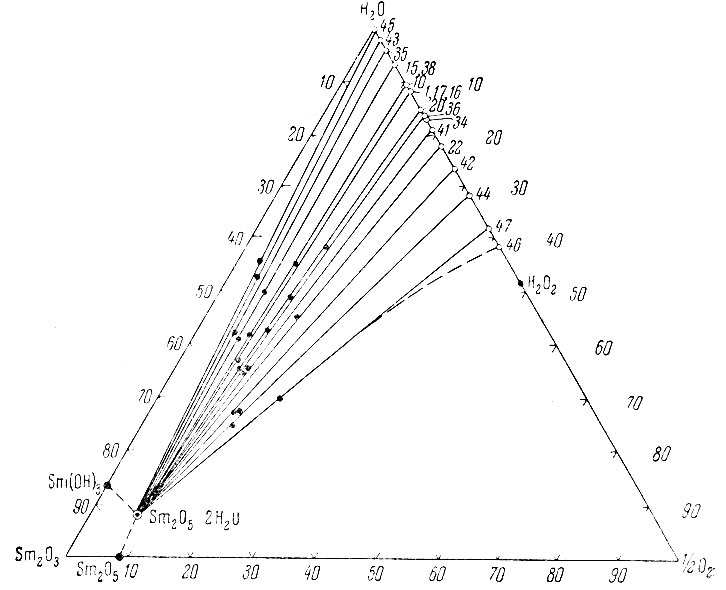
Рис. 3. Изотерма 0° С тройной системы Sm(OH)3 - Н2O2 - Н2O
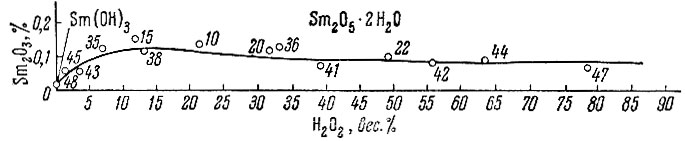
Рис. 4. Изотерма 0° С тройной системы Sm(OH)3 - Н2O2 - Н2O в прямоугольных координатах
При исследовании тройных систем общего типа Ln(OH)3 - Н2O2 - Н2O, где Ln = La, Рr, Nd, Sm, Gd, Er, Sc, и системы Э(ОН)4 - H2O2 - Н2O нами был применен метод "остатков" с определением состава твердых фаз по Шрейнемакерсу. Для исследования систем применяли только свежеприготовленные гидроокиси, которые наиболее активно взаимодействуют с перекисью водорода. Аналитические данные изучения систем состава Ln(ОН)3 - Н2O2 - Н2О наносили на диаграммы Ln2O3 - Н2О - 1/2O2 и Ln2O3 - Н2O2, а систем типа Э(ОН)4 - Н2О2 - 1/2O2.
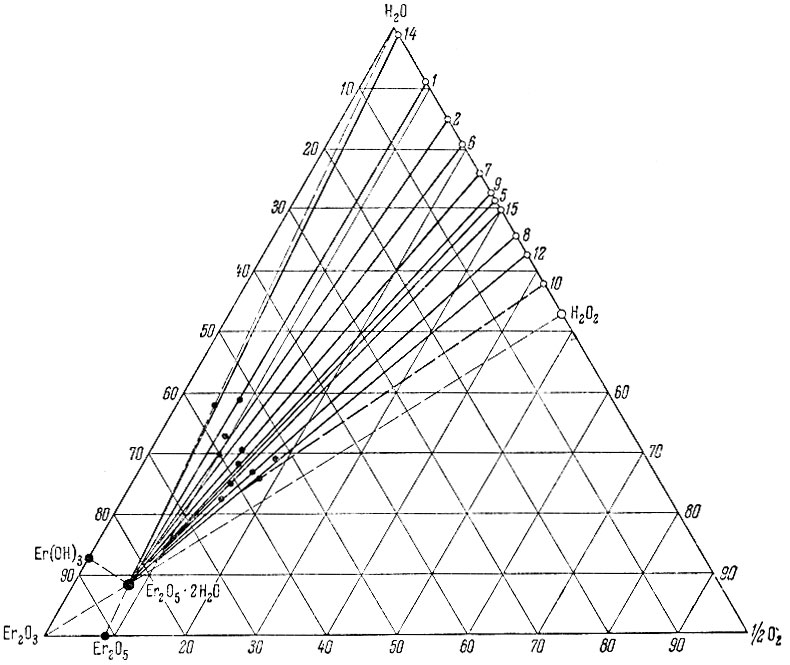
Рис. 5. Изотерма 0° С тройной системы Er(ОН)3 - Н2О2 - Н2О
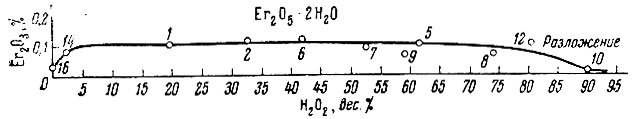
Рис. 6. Изотерма 0° С тройной системы Er(ОН)3 - Н2О2 - Н2О в прямоугольных координатах
Из рассмотрения нулевых изотерм тройных систем La(OH)3 - Н2O2 - Н2O, Sm (ОН)3 - Н2O2 - Н2O, Еr(ОН)3 - Н2O2 - Н2O и Се(ОН)4 - Н2O2 - Н2O (рис. 1-7) следует, что, кроме фаз гидро-окисного типа, образуются перекисные соединения состава La2O4 × 2Н2O, Sm2O5 × 2H2O, Еr2O5 × 2Н2O, СеO3 × 2Н2O и СеO3.
Совокупность экспериментального материала по изученным системам позволяет заметить, что гидроокиси нечетных элементов (La, Рr, Sc) при взаимодействии с Н2O2 образуют перекисные соединения общего состава Ln2O4 × 1-2Н2O, а гидроокиси четных рзэ (Nd, Sm, Gd, Er) - Ln2O5 × 2H2O.
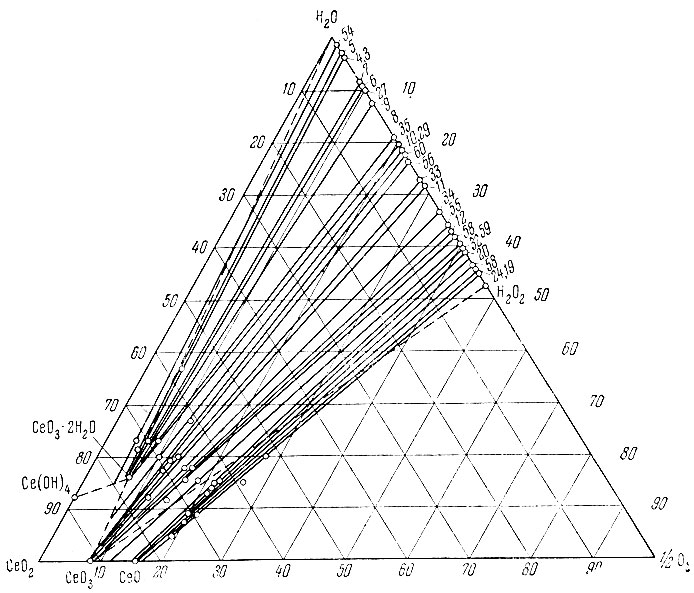
Рис. 7. Изотерма 0° С тройной системы Се(ОН)4 - Н2О2 - Н2O
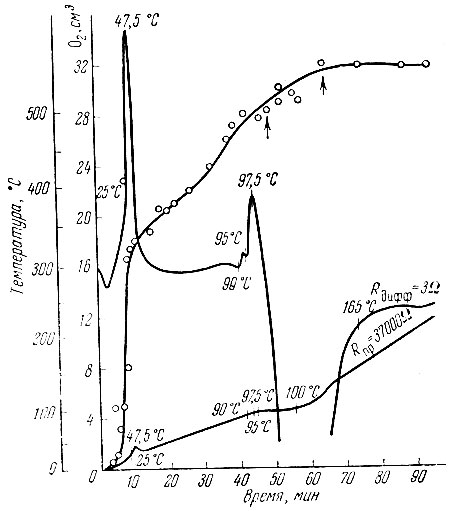
Рис. 8. Дифференциальные кривые нагревания остатка, отвечающего твердой фазе Pr2O4×2H2O
Дифференциальные кривые нагревания "остатков", соответствующих твердым фазам Ln2O4 × 1-2Н20 и Ln2O5×2H20, а также данные изменения химического состава продуктов при нагревании показали довольно сложный характер разложения (рис. 8).
При температуре первого экзотермического эффекта выделяется активный кислород из Н2O2, адсорбированной продуктом. В пределах 80-200° С перекисные соединения рзэ разлагаются до Ln2O3×xH2O с выделением активного кислорода и части воды.
Нами были также синтезированы перекисные соединения La, Рг, Nd, Sm, Gd, Er, Sc, Y и Ce(IV) из растворов их нитратов (для Се из сульфата), аммиака и Н2O2. При непродолжительном высушивании над Р2О6 перекиси рзэ имели состав, близкий к Ln2O5 × nН2O, при длительном высушивании их состав приближается к Ln2O4×xH2O. Перекись церия имела состав СеO3×2Н2O. В результате проведенной работы по дегидратации перекисей рзэ различными способами выяснилось, что обезводить их не удается. Это обстоятельство позволяет высказать предположение о достаточно прочной связи воды и активного кислорода в перекисях рзэ.
Перекисные соединения изученных элементов имеют различный цвет: La и Sm -кремовый, Рг - светло-зеленый, Nd - сиреневый- Gd, Y и Sc - белый, Ей - розовый, Се - от оранжевого до темно-коричневого.
На основе наших работ и данных других исследователей [1-20] можно предположить, что перекисные соединения рзэ (III) и (перекиси четырехвалентных элементов подгруппы титана) - истинные перекиси, характеризующиеся наличием перекисной группы -О - О-. Согласно литературным данным [6, 13, 14, 16, 18, 19], эти соединения лучше изображать в виде гидроперекисей Ln(OOH) (OН)2×xН2O для рзэ и Э(ООН) (OН)3×nН2O для элементов подгруппы титана. По-видимому, механизм реакции образования перекисей рзэ из гидроокисей и Н2O2 следующий:
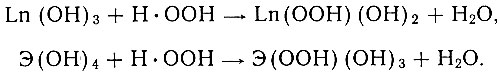
Структурные формулы можно изобразить как
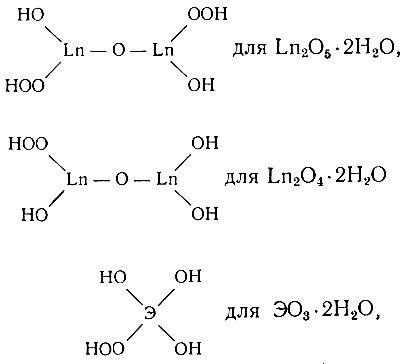
либо в виде двуядерного аквокомплекса:
(в первом случае)
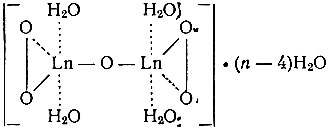
(во втором случае)
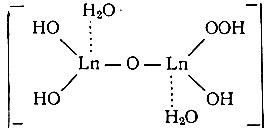
Перекисные соединения рзэ вполне целесообразно рассматривать в виде комплексов, так как эти элементы проявляют значительную способность к комплексообразованию, а пероксогруппа (ОО)2- - типичный лиганд [21].
Литература
- М. Р. Т. Сlёvе. Bull. Soc. chim. France, 43, 57 (1885).
- P. G. Melikov, L. P. Pissarzhevskij. Z. anorg. allg. Chem., 21, 70 (1899).
- B. Brauner. Proc. Chem. Soc., 14, 72 (1889).
- B. Brauner. Proc. Chem. Soc., 17, 66 (1901).
- B. Brauner. Z. anorg. allg. Chem., 32, 1 (1902).
- П. Г. Меликов, Б. E. Клименко. ЖРФХО, 33, 663 (1901).
- Г. Б. Сейф ер, Е. А. Ионова. ЖНХ, 5, 223 (1960).
- R. Hermann. J. prakt. Chem., 30, 184 (1843).
- L. de Boiboudran. Comt. rend., 100, 605 (1885).
- G. H. Bailey. Jsb. Chem., 1885, 1941.
- М. P. T. Cleve. Jsb. Chem., 1885, 491.
- Л. П. Писapжeвский. ЖРФХО, 32, 609 (1900).
- В. В. Серебренников. Химия редкоземельных элементов. Изд. Томского ун-та, 11959, стр. 265.
- A. Lawson, Е. Ваlsоn. J. Chem. Soc., 1935, 362.
- Н. Classen. Вег., 21, 370 (1888).
- R. Schwarze, Н. Giese. Z. anorg. allg. Chem., 176, 209 (1928).
- G. H. Bailey. Jsb. Chem., 1889, 115.
- D. Gantz, L. Lambert. J. Phys. Chem., 61, 112 (1957).
- T. Macrae, H. Wieland. Ann., 483, 229 (1930).
- H. Wieland, B. Riesenfeld. Ann., 477, 72 (1930).
- И. И. Черняев, В. А. Головня, Г. А. Эллерт. ЖНХ, 6, 790 (1961).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'