
Экстракционные методы разделения редкоземельных элементов (Г.В. Корпусов, Е.Н. Патрушева)
Первые сообщения об экстракции рзэ органическими растворителями появились в тридцатых годах [1-3]. Большая часть (работ сводилась к изучению растворимости различных солей рзэ в простых органических растворителях: спиртах, кетонах, эфирах и т. д. [4-8]. Некоторые исследования были посвящены изучению закономерностей распределения рзэ в системах: спирты, кетоны, эфиры и водные растворы нитратов, хлоридов, роданидов [9-13]. Во всех случаях коэффициенты разделения рзэ были значительно меньше двух при очень малых величинах коэффициентов распределения [14-16].
Было установлено, что величины факторов распределения рзэ, как правило, возрастают с увеличением атомного номера элемента от лантана к лютецию; иттриевая и цериевая подгруппы рзэ несколько отличаются по экстракционным свойствам, причем гадолиний - граничный элемент [5].
Новые перспективы в экстракционном разделении рзэ открылись после исследований Уорфа и Пеппарда [14-19], применивших в качестве экстрагента нормальный трибутиловый эфир ортофосфорной кислоты (ТБФ). Интенсивное изучение экстракционного выделения микроколичеств рзэ в основном связано с запросами атомной промышленности [20-23], так как рзэ цериевой подгруппы составляют значительную часть продуктов деления урана. На основании проведенных работ были сделаны основные выводы о химизме распределения рзэ [24- 36] и возможностях выделения их больших количеств. Однако до настоящего времени опубликовано очень мало работ по технологии выделения рзэ в промышленных масштабах [37-46]. Некоторое исключение составляет церий, который в четырехвалентном состоянии может быть выделен избирательно многими кислородсодержащими органическими растворителями, 'начиная с простых эфиров и кетонов [47-65].
Одно из направлений дальнейших исследований в области технологии разделения рзэ - изыскание новых, более эффективных, чем ТБФ, экстрагентов и систем [66-73]. В области теоретических исследований еще предстоит количественное определение термодинамических констант распределения и других параметров, которые позволят глубже разобраться в химизме экстракционных процессов рзэ.
Экстракционный процесс разделения рзэ (как и всякий другой процесс разделения) включает равновесное распределение между двумя фазами, кинетику наступления этого равновесия и динамику процесса разделения.
Закономерности равновесного распределения рзэ между двумя фазами
В технологии разделения рзэ находят в основном применение нитратные системы, хотя в частных случаях возможно использование хлоридных и роданидных систем [7, 74]. В настоящей работе рассматриваются только нитратные системы.
Правильное понимание механизма распределения рзэ невозможно без знания химии водных растворов этих элементов.
Известно, что свойства рзэ и характеризующие их константы меняются монотонно от лантана к лютецию, причем гадолиний в силу своей электронной конфигурации с наполовину заполненным подуровнем 4f делит рзэ на две подгруппы, элементы которых почти во всех химических процессах несколько отличаются по свойствам.
При рассмотрении всей группы рзэ можно отметить, что прочность связи для различных форм соединений возрастает от лантана к лютецию. Изменения величин констант любого процесса укладываются в 3-4 порядка, что соответствует различию в константах двух соседних элементов в 2-3 раза. Поэтому можно ожидать, что и IB любом процессе распределения, который по существу представляет процесс образования химических соединений, максимальное различие в константах (и соответственно в коэффициентах распределения) не может превышать указанной величины. Это следует всегда учитывать при оценке эффективности любого растворителя, выбираемого для разделения рзэ, чтобы избежать абсурдных требований к селективности экстрагента.
Экстракция рзэ нейтральными фосфорорганическими соединениями
В технологии разделения рзэ находят, либо могут найти, наибольшее применение соединения, относящиеся к классу фосфатов (RO)3PO, фосфонатов (RO)2RPO и фосфиноксидов R3PO. Активная группировка нейтральных фосфорорганических соединений - фосфорильная группировка или, вернее, кислород фосфорила. Экстрагенты указанных классов могут образовывать два ряда соединений с извлекаемыми веществами в зависимости от характера образующейся связи. В первом случае молекула растворителя сольватирует катион металла извлекаемого соединения, во втором- осуществляется водородная связь, что характерно для экстракции кислот или комплексных кислых соединений, где металл находится в анионной группировке [29, 75, 76]. Эти два типа соединений образуются при экстракции рзэ.
Распределение индивидуальных элементов
Изучение закономерностей распределения индивидуальных элементов дает возможность получить основные исходные сведения о составе экстрагируемых соединений, данные о зависимости коэффициентов распределения от состава фаз и другие экстракционные характеристики системы.
В рассматриваемых системах извлечение рзэ происходит по схеме:
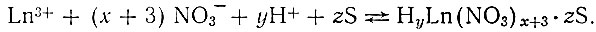
В соответствии с . написанным, рзэ могут экстрагироваться в двух формах: в виде простых солей, сольватированных определенным числом молекул органического растворителя, чаще всего состава Ln(NO3)3×3S [24, 29]; либо в виде комплексных кислот (в зависимости от концентрации HNO3) в предельном случае состава Н3[Ln(NO3)6]. При изменении концентрации HNO3 от 0,01 до 15-16 М в состав экстрагируемого комплекса входят три молекулы ТБФ (рис. 1), где угловой коэффициент прямых в билогарифмических координатах определяет число молекул растворителя в сольвате. При полном насыщении органической фазы рзэ как в кислых, так и в нейтральных растворах соотношение между количеством рзэ и растворителя в подавляющем большинстве случаев равно 1 : 3, что соответствует указанной выше стехиометрии. Экстракция рзэ в виде комплексных кислот подтверждается большим числом косвенных данных [29, 75, 76], однако прямых доказательств пока еще нет.
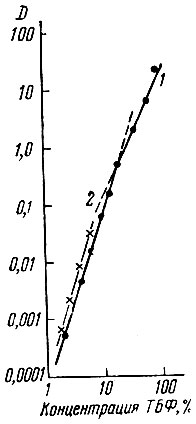
Рис. 1. Зависимость логарифма D от концентрации ТБФ в талуоле для церия в 15N HNO3 (1) для европия в 6 N NH4NO3 (2)
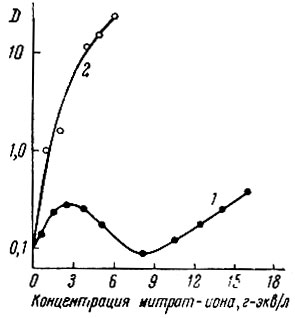
Рис. 2. Зависимость коэффициента распределения (D) церия от концентрации нитрат-иона в водном растворе в случае HNO3 (1) и NH4NO3 (2)
Азотная кислота также экстрагируется рассматриваемыми растворителями, что и определяет характер зависимости коэффициентов распределения рзэ от концентрации кислоты в системе. Так, например, на рис. 2 показано распределение нитрата церия в зависимости от концентрации нитрат-иона в присутствии HNO3 и NH4NO3. Как видно, значения коэффициентов распределения церия при экстракции из азотнокислых растворов значительно ниже, чем при экстракции в присутствии NH4NO3. Это связано с соэкстракцией макроколичеств самой HNO3, Так как по прочности связи с ТБФ азотная кислота близка к неодиму, то ее экстракция особенно сказывается на распределении низших рзэ.
Появление минимума на кривых распределения (рис. 3) при переходе от иттриевых элементов к цериевым и объясняется экстракцией азотной кислоты. Подъем кривых распределения с увеличением концентрации кислоты в водной фазе связан с образованием экстрагируемых форм комплексных кислот рзэ. Абсолютные значения коэффициентов распределения рзэ зависят не только от концентрации кислоты или высаливателя, но и от концентрации самого рзэ в системе (рис. 4). Падение величин коэффициентов распределения рзэ при очень (высокой концентрации их в водной фазе связано с тем, что емкость растворителя ограничена. Для нейтральных экстрагентов величина емкости соответствует в основном стехиометрическому составу. Так, например, в таблице приведены данные о составе органической фазы для разных условий экстракции.
![Рис. 3. Зависимость коэффициентов распределения (D) нечетных рзэ от равновесной концентрации HNO3 в водной фазе [27]](pic/000386.jpg)
Рис. 3. Зависимость коэффициентов распределения (D) нечетных рзэ от равновесной концентрации HNO3 в водной фазе [27]
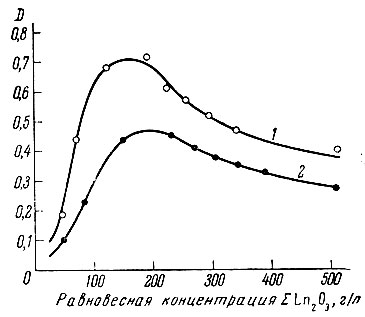
Рис. 4. Зависимость коэффициентов распределения (D) суммы рзэ цериевой подгруппы от их равновесной концентрации в водной фазе. 1 - 100%-ный ТБФ; 2 - 70%-ный ТБФ
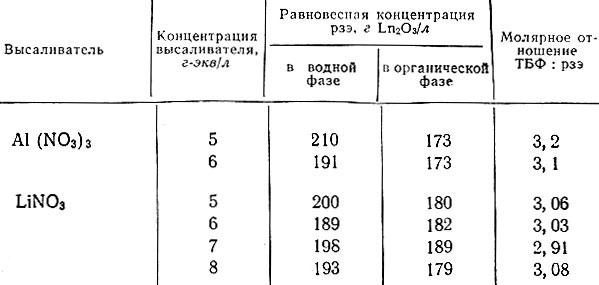
Изменение емкости ТБФ при экстракции рзэ цериевой подгруппы в зависимости от концентрации высаливателя. Состав концентрата (в %): La - 26, Се - 52,7, Рr - 3, Nd - 15, Sm - 1,7, Gd - 1, Tb - 0,2, Dy - 0,4
Распределение рзэ в многокомпонентных смесях
На практике при изучении условий разделения рзэ, представляющих многокомпонентную смесь, лишь в частных случаях можно пользоваться данными, полученными при изучении распределения индивидуальных элементов, например, тогда, когда рзэ имеют невысокие значения коэффициентов распределения или концентрация их невелика. Во всех остальных случаях необходимо изучать одновременное распределение рзэ в выбранных системах. Из приведенных на рис. 3, 5 и 6 экспериментальных данных видно, коэффициентов распределения рзэ что характер изменения величин при экстракции из азотнокислых, а также из слабокислых сред в присутствии высаливателя и при экстракции из концентрированных растворов самих рзэ будет один и тот же. Существуют три области: средняя, в которой различия в коэффициентах распределения практически нет; область концентрированных растворов, в которой различие в коэффициентах распределения увеличивается с ростом концентрации кислоты, высаливателя или самих рзэ, и область инверсии в разбавленных растворах, где различие величин коэффициентов распределения также увеличивается с уменьшением концентрации указанных параметров, но в обратном порядке, т. е. более легкий элемент экстрагируется лучше более тяжелого элемента [18, 19, 24, 66].
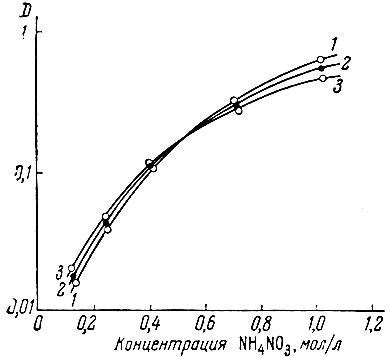
Рис. 5. Зависимость коэффициентов распределения (D) церия, прометия и европия от концентрации NH4NO3
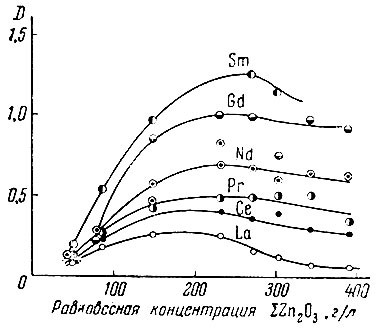
Рис. 6. Зависимость коэффициентов распределения (D) рзэ от равновесной концентрации их суммы в водной фазе, 1 - Еu; 2 - Pm; 3 - Се
Впервые явление инверсии было замечено Пеппардом и Мак-Кеем в кислых растворах [18, 24]. Последний отметил также некоторое различие в экстракционных свойствах четных и нечетных элементов иттриевой подгруппы и разное положение точек инверсии для цериевой и иттриевой подгрупп рзэ.
Так, например, на рис. 7 и 8 приведены данные о зависимости коэффициентов распределения рзэ от их атомного номера при экстракции макроколичеств в слабокислых растворах в присутствии высаливателя и без него для ТБФ [66], диизоамилового эфира метилфасфиновой кислоты (ДАМФК) [66] и фосфиноксида [77].
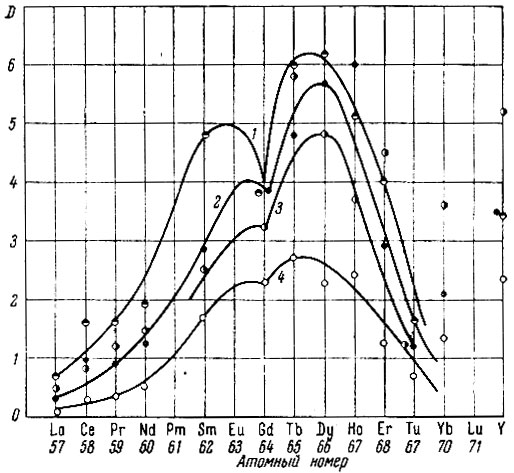
Рис. 7. Зависимость коэффициентов распределения (D) рзэ от их атомного номера при экстракции раствором ТБФ в ксилоле в присутствии 6 г-экв Аl(NO3)3. 1 - 100%-ный ТБФ; 2 - 70%-ный ТБФ; 3 - 50%-ный ТБФ; 4 - 25%-ный ТБФ
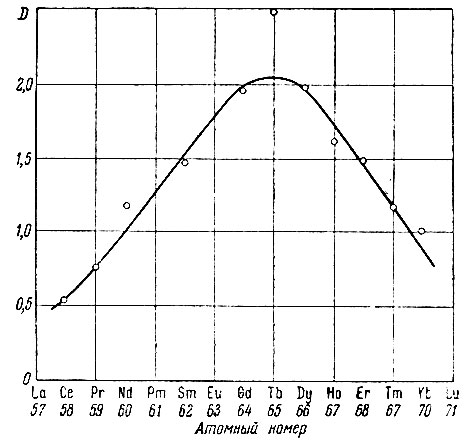
Рис. 8. Зависимость коэффициентов распределения (D) рзэ от их атомного номера при экстракции ДАМФК.Равновесная концентрация ΣLn2O3 в водной фазе 200 г/л
Отметим, что равновесная концентрация суммы рзэ составляла 150 г окиси на 1 л водного раствора. Концентрат содержал примерно 65% элементов иттриевой группы (см. рис. 7).
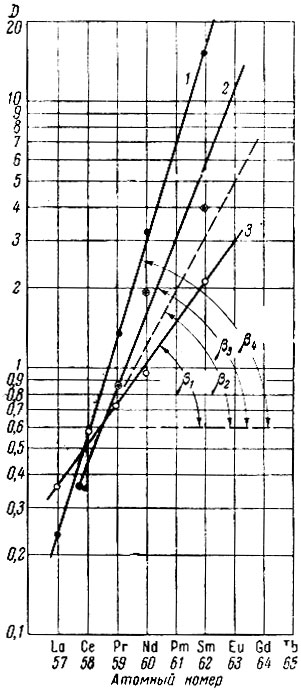
Рис. 9. Зависимость коэффициентов распределения (D) рзэ цериевой подгруппы от их атомного номера в случае различной концентрации LiNO3 в водной фазе при экстракции ТБФ. 1 - 8М LiNO2; 2 - 5М LiNO3; 3 - без лития
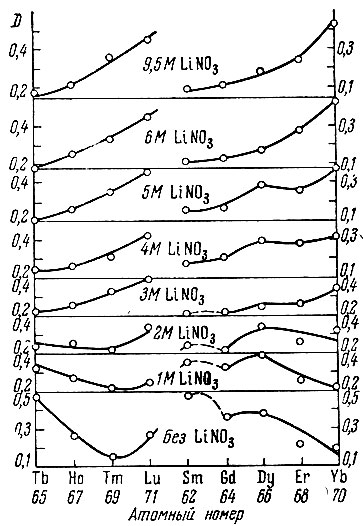
Рис. 10. Зависимость коэффициентов распределения (D) рзэ иттриевой подгруппы от их атомного номера при экстракции 0,5 М ТБФ в кислоте в присутствии различных количеств LiNO3
По нашему мнению, главная причина инверсии связана с конкуренцией двух процессов: гидратации и сольватации рзэ. Прочность связи при этих процессах возрастает в обычном порядке - от лантана к лютецию. Однако при распределении рзэ в системе двух фаз действие этих процессов направлено в различные стороны; поэтому и характер распределения будет определяться доминирующим процессом. При экстракции растворителями, образующими соединения средней прочности, прямая зависимость, т. е. возрастание коэффициентов распределения с увеличением атомного номера, наблюдается только в том случае, когда активная концентрация воды значительно снижена. На практике это проявляется при введении в систему высаливателей или при повышении концентрации самих рзэ (самовысаливание). Следует помнить, что увеличение концентрации любых нитратов в водном растворе также увеличивает концентрацию общего аниона. Чем выше концентрация высаливателя, тем больше различие в величинах коэффициентов распределения рзэ. Это иллюстрируется рис. 9, на котором показана зависимость логарифмов коэффициентов распределения рзэ от их атомного номера. Экстракцию проводили при равновесной концентрации суммы окислов рзэ в водной фазе 200 г/л, для концентрата следующего состава (в%): La -26; Се -52,7, Рг -3; Nd - 15; Sm-1,7; Gd - 1; Еr - 0,22; Dy - 0,4. При одной и той же равновесной концентрации рзэ угол наклона, характеризующий коэффициент разделения, значительно больше для растворов с высаливателем. Количественно изменение свойств ионов в водных растворах можно оценить, лишь изучая изменение коэффициентов активности этих ионов в зависимости от концентрации различных нитратов и HN03 в водных растворах.
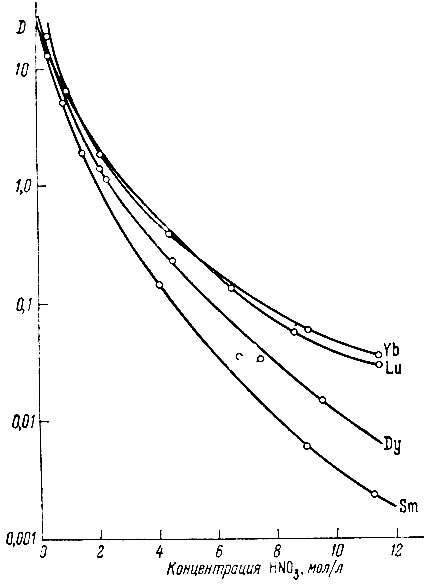
Рис. 11. Зависимость коэффициентов распределения (D) индикаторных количеств рзэ от концентрации HNO3 в водной фазе при экстракции 0,9 М раствором трибутилфосфиноксида в ксилоле
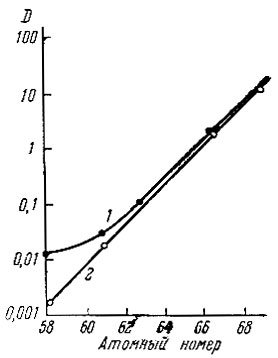
Рис. 12. Зависимость логарифма коэффициентов распределения (D) рзэ от их атомного номера при экстракции 0,95 М раствором диамилфосфорной кислоты в бензоле 1 - примесь 7% моноамилфосфорной кислоты; 2 - чистая диамилфосфорная кислота
В слабокислых растворах в присутствии больших количеств рзэ и высаливателя область инверсии иттриевых элементов несколько более растянута. На практике нельзя получить концентрацию высаливателя больше 5-6 мол/л и выйти из области инверсии иттриевых элементов, что делает невозможным разделение их в описанных условиях.
Следует подчеркнуть, что некоторые авторы, измеряя концентрационные константы образования комплексных соединений рзэ, допускают грубые ошибки, не учитывая указанных явлений. Как правило, все определения констант проводят при невысоких концентрациях солей в водных растворах (ионная сила 1, 2, 4), т. е. в тех условиях, когда может наблюдаться минимальное различие как в коэффициентах распределения, так и в концентрационных константах.
На основании полученных величин констант можно, например, сделать неправильные выводы о том, что рзэ образуют комплексы либо одинаковой прочности [78, 79], либо церий комлексуется лучше иттрия [31, 78, 79]. В том случае, когда используют растворители, дающие прочные соединения с рзэ, процесс образования экстрагируемых соединений доминирует над процессом гидратации, и область инверсии резко сокращается (рис. 10*, 11) [77] или совсем исчезает (рис. 12) [27].
* (Был взят концентрат следующего состава (в %): Sm - 7; Gd - 12; Tb - 8; Dy - 13; Но - 6; Er - 15; Tu - 1,5; Yb - 23; Lu - 4,5; Y - 10.)
Сравнительные данные по экстракции рзэ различными органическими соединениями
Как следует из литературных данных [80], активность кислорода группы фосфорила увеличивается в ряду фосфат, фосфонат, фосфинат, фосфиноксид. Параллельно возрастает и прочность связи экстрагента с экстрагируемым соединением [81]. Подобная картина наблюдается и при экстракции рзэ. На рис. 13 показана зависимость коэффициентов распределения европия от концентрации HNO3 при экстракции бутил производными соединениями, относящимися к классу фосфатов, фосфонатов, фосфинатов и фосфиноксидов. Соответствуя изложенному, коэффициенты распределения европия увеличиваются при переходе от фосфата к фосфиноксиду. Так как прочность связи экстрагента увеличивается не только для рзэ, но и для кислоты в указанном ряду соединений, максимум на кривых распределения европия, связанный с экстракцией HNO3 сдвигается в сторону меньших кислотностей. При экстракции церия и европия (ДАМФК) получаются вдвое большие коэффициенты распределения, чем при экстракции ТБФ (рис. 14). Коэффициенты разделения при экстракции этими двумя растворителями примерно одинаковы.
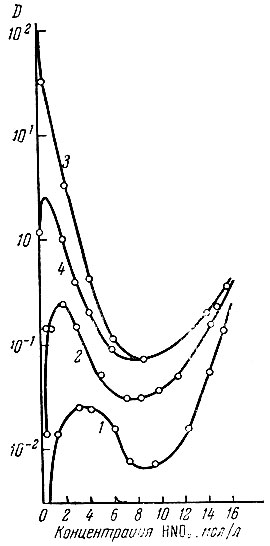
Рис.13. Зависимость коэффициента распределения (D) индикаторных количеств европия от концентрации HNO3 в водной фазе при экстракции 0,98 М растворами. 1 - ТБФ; 2 - бутилфосфоната; 3 - бутилфосфоната; 4 - бутилфосфиноксида
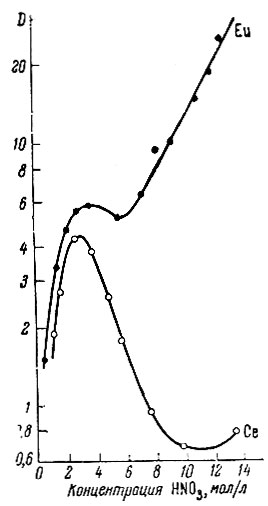
Рис. 14. Зависимость коэффициентов распределения (D) индикаторных количеств церия и европия от концентрации HNO3 в водной фазе при экстракции ДАМФК
При экстракции ТБФ в слабокислых растворах в отсутствие высаливателя можно осуществлять разделение лишь элементов цериевой подгруппы. Наибольший эффект дает групповое разделение на цериевую и иттриевую подгруппы, включая самарий. Коэффициенты разделения в этом случае при равновесной концентрации рзэ в водной фазе 300- 400 г Ln2O3/л составляют 1,7-2 для Nd - Sm и 1,25-1,35 для Nd -Рr. Указанная система в частных случаях может быть применена для разделения некоторых пар иттриевых элементов [67].
В азотнокислых растворах, начиная с концентрации кислоты 6-8 мол/л, коэффициенты разделения рзэ достигают приемлемых для разделения величин.
Так, например, в 8 М HNO3 коэффициенты разделения Sm - Nd, Nd - Рr соответственно равны 2,5-2,8 и 1,3-1,4 [67]. Равновесная концентрация рзэ в данных опытах в водной фазе составляла примерно 200-300 г Ln2O3/л. При этом коэффициенты распределения цериевой группы практически не менялись с увеличением их концентрации в водной фазе вплоть до 200-250 г Ln2O3/л, что значительно облегчает проведение расчета процесса разделения.
При более высоких концентрациях кислоты увеличивается различие в коэффициентах распределения всех рзэ, в том числе и иттриевых, разделение которых на отдельные подгруппы и элементы практически можно проводить в 12-13 М кислоте.
Однако величины коэффициентов распределения иттриевых элементов в значительной степени зависят от их концентрации в водной фазе [67]. Азотнокислые растворы практически непригодны для разделения La, Се (III), Рг из-за низких значений коэффициентов распределения и разделения.
В слабокислых растворах с высаливателем наиболее удобно осуществлять разделение элементов цериевой подгруппы, так как, начиная с концентрации высаливателя 2-3 г-экв/л и выше (до 5-6), коэффициенты разделения всех элементов этой подгруппы увеличиваются от 1,5-1,6 до 1,8-2 [66]. При экстракции ДАМФК получаются примерно аналогичные результаты.
Экстракция рзэ кислыми экстрагентами
В работах, посвященных экстракции рзэ кислыми, в основном алкил- фосфорными экстрагентами [22, 82-84], описываются лишь закономерности распределения и выделение только микроколичеств рзэ. Кислые экстрагенты, как правило, представляют слабые органические кислоты, которые с экстрагируемыми элементами образуют либо простые соли (например, жирные кислоты), либо сложные внутрикомплексные соединения. Последние также образуются путем замещения водорода кислоты ионом экстрагируемого металла (например, в случае тиофенкарбонил-трифторацетона - ТТА). Экстракция кислыми экстрагентами зависит от концентрации ионов водорода в системе, которые определяют степень диссоциации кислоты и, следовательно, концентрацию экстрагируемой анионной формы (рис. 15).
При экстракции алкилфосфорными кислотами величины коэффициентов распределения рзэ прямо пропорциональны третьей степени концентрации экстрагента в органической фазе, обратно пропорциональны третьей степени концентрации ионов водорода в водном растворе и практически не зависят от концентрации нитрат-ионов в системе.
Это позволяет сделать вывод, что рзэ извлекаются этими экстрагентами в виде соединений Ln(A)3 или с учетом полимеризации кислоты в органической фазе Ln[(A)×HA]3, где НА - молекула органической кислоты [25, 27]. Подобный механизм экстрагирования наблюдается в слабокислых растворах.
При экстракции кислыми растворителями, содержащими в молекуле несколько активных группировок, может наблюдаться смешанный механизм экстракции. Так, например, при экстракции алкилфосфорными кислотами из сильнокислых растворов, когда диссоциация органической кислоты полностью подавлена, экстракция протекает за счет сольвати- рования соли рзэ молекулами кислоты при участии кислорода фосфорильной группировки [27]. Только изменением механизма экстракции можно объяснить подъем кривых распределения рзэ с увеличением концентрации HNO3 до 9 М при экстракции диамилфосфорной кислотой (рис. 16). Прочность связи рзэ с кислыми экстрагентами достаточно велика, и явление инверсии не наблюдается отчетливо. Зависимость величин коэффициентов распределения рзэ от их атомного номера чаще всего представляет прямую линию [27]. В некоторых случаях проявляется различие в экстракционных свойствах иттриевой и цериевой подгрупп. Так, Шека и Крисс [85] обнаружили на кривых констант экстракции излом, соответствующий положению Sm, Eu, Gd, Tb.
Алкилфосфорные кислоты, характеризующиеся высокими коэффициентами разделения [28, 30, 86], могут быть применены пока для разделения только микроколичеств рзэ, так как растворимость их солей с этими кислотами в органической фазе очень невелика. Для перехода к выделению макроколичеств рзэ необходимо подыскать такие разбавители, в которых растворимость солей была бы удовлетворительной.
Растворимость органических солей рзэ в других кислых экстрагентах может быть достаточно большой. Так, емкость жирных кислот превышает 100 г Ln2O3/л органической фазы. Для выделения рзэ при помощи жирных кислот пока еще не найдены условия, при которых бы коэффициенты разделения достигали приемлемых значений.
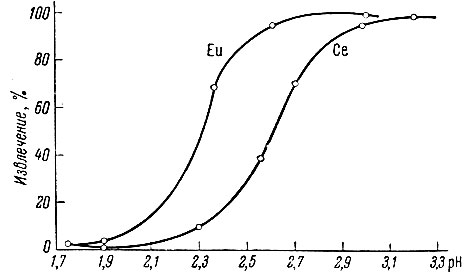
Рис. 15. Извлечение европия и церия смесью карбоновых кислот (С7 - С9) в зависимости от pH водной фазы в присутствии 5 N LiNO3
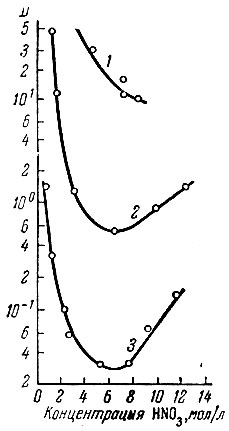
Рис. 16. Зависимость коэффициентов распределения (D) индикаторных количеств иттрия и европия от концентрации HNO3 в водной фазе при экстракции диамилфосфорной кислотой. 1 - Y, концентрация диамилфосфорной кислоты в керосине 2,45 М; 2 - Y в бензоле - 0,98 М; 3 - Eu в бензоле - 0,98 М
Применение комплексообразующих агентов в экстракционном процессе разделения рзэ
В аналитических целях, а также при выделении микроколичеств рзэ применяют оксихинолин, купферон, ТТА и т. д. [87-97]. Комплексные соединения рзэ с подобными (веществами преимущественно растворимы в органических средах, но незначительно, что исключает их применение в технологии выделения рзэ. При экстракционных процессах разделения рзэ можно использовать этилендиаминтетрауксусную кислоту (ЭДТА) и ее соли, нитрилоксиуксусную кислоту и т. д. Эти реагенты и их соединения с рзэ растворимы
лишь в водных растворах и практически не растворимы в органических веществах. Их можно применять только в таких системах, где соли рзэ в отсутствие комплексообразующих агентов полностью находятся в органической фазе, т. е. коэффициенты распределения их должны быть не меньше 20-30. Это достигается обычно либо введением в систему высаливателей при экстракции ТБФ или ДАМФК, либо применением более сильных экстрагентов (например, фосфинокиси).
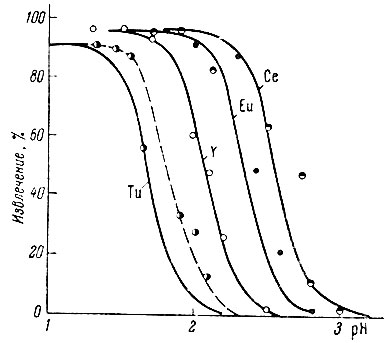
Рис. 17. Извлечение рзэ ТБФ в зависимости от pH водной фазе в присутствии 8 г-экв/л. LiNO3 и ЭДТА. Сплошные кривые проведены согласно расчету
При использовании указанных систем следует учитывать, что процесс сольватации в органической фазе и процесс комплексообразования в водном растворе взаимно гасят друг друга. Поэтому необходимо выбирать такие условия, когда бы извлечение рзэ проходило при инверсии величин коэффициентов распределения. Проще всего подобные условия создать для тяжелых иттриевых элементов. Наблюдаемый коэффициент распределения рзэ в присутствии комилексообразующего агента в общем случае может быть выражен следующим уравнением:
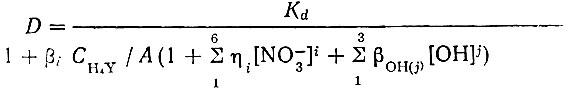
где βон и η -соответственно, константы гидролиза и комплексообразования рзэ с нитрат-ионом;
или
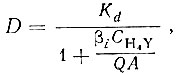
где
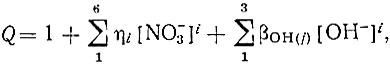
(Kd - коэффициент распределения рзэ без комплексообразующего агента β - константа комплексообразования рзэ ЭДТА; CН4Y - суммарная концентрация незакомплексованной формы ЭДТА; А - величина, равная
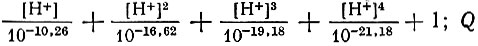
величина, которая учитывает гидролиз и комплексообразование рзэ с нитрат-ионом).
Для других комплексообразующих агентов формулы будут иметь аналогичный вид.
При достаточно больших величинах Ка в формуле можно пренебречь единицей. Тогда выражение для наблюдаемого коэффициента примет такой вид:
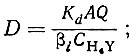
и коэффициент разделения двух соседних рзэ будет выражаться следующим образом:
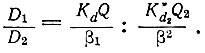
На рис. 17 показана зависимость степени извлечения рзэ от концентрации ионов водорода при экстракции ТБФ в присутствии ЭДТА. При использовании комплексообразующих агентов для разделения тяжелых рзэ иттриевой группы можно получить высокие значения коэффициентов разделения (порядка 2-3).
Экстракция рзэ аминами
Экстракция аминами подобна сорбции амино- или алкиламмониевыми группами в ионообменных смолах. Из этого следует, что амины могут быть использованы для выделения металлов, находящихся в водных растворах в виде анионов [80].
Рзэ содержатся в анионной форме в растворах с высоким содержанием неорганического аниона (8-10 мол!л). Такая концентрация аниона достигается введением в систему соответствующих минеральных кислот либо солей металлов, имеющих высокую растворимость в водных растворах и не экстрагирующихся аминами. Для экстракции рзэ могут быть использованы третичные и первичные длинноцепочные разветвленные алкиламины [99-103]. Третичные амины, в частности три-изо-октиламин [101], могут применяться для разделения рзэ и отделения их от актиноидов.
Экстракцию проводят в концентрированных растворах хлорида лития при невысоком содержании НС1. Извлечение рзэ увеличивается с повышением концентрации хлор-иона, т. е. с увеличением содержания анионной формы рзэ.
Предполагается следующий механизм экстрагирования:
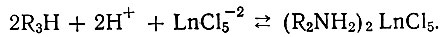
Экстракция рзэ уменьшается в ряду Eu > Pm > Се > Y > Tu. Приведенный порядок экстрагирования трудно объясним.
При подборе соответствующего разбавителя, концентрации кислоты, высаливателя и самого амина степень извлечения микроколичеств рзэ при экстракции три-изо-октиламином может достигать 90% и более.
Для разделения количества рзэ в растворах, содержащих 6 М HNO3, можно использовать три-н.бутиламин. Было изучено [102] влияние концентрации самих рзэ, экстрагента и кислоты, а также природы разбавителя на величину коэффициента разделения рзэ. В определенных условиях были получены следующие величины коэффициентов разделения для пар элементов: 4,45 для Y - Sm; 1,75 - Y - Dy; 1,44 - Y - Еr. Приведенные значения факторов разделения позволяют проводить многоступенчатое разделение рзэ.
Сульфаты рзэ экстрагируются лишь первичными аминами [99].
Разделение рзэ в трехвалентном состоянии может осуществляться только #как многоступенчатый процесс. На практике для разделения рзэ применяют в основном два типа экстракционных процессов: противоточный [37, 42, 67, 78] и полупротивоточный [6, 20]. В первом случае для разделения компонентов N смеси при полном противотоке необходимо иметь N-1 экстракционных каскадов. При полупротивоточном процессе разделения, напоминающем до некоторой степени хроматографический процесс, можно одновременно получить несколько компонентов в чистом виде на одном экстракционном каскаде. Экстракционные процессы разделения рзэ довольно точно рассчитываются как аналитическими, так и графическими методами [47, 104, 105]. Все методы расчета сводятся в основном к рассмотрению двух предельных случаев, когда наблюдается постоянство коэффициентов распределения или коэффициентов разделения. В последнем случае полностью применимы общие законы разделения, наиболее полно разработанные для процесса разделения изотопов [106]. Для осуществления экстракционного процесса разделения рзэ как в лабораторных, так и в промышленных масштабах, по-видимому, наибольшее применение найдут горизонтальные экстракторы типа смеситель-отстойник.
Литература
- R. С. Weis, J. Wash. Acad. Sci., 20, 196 (1930).
- W. Fisсher, W. Dietz, O. Obermann. Naturw., 25, 348 (19371).
- D. B. Appleton, P. W. S el wood. J. Am. Chem. Soc., 63, 2029 (1941).
- W. Fischer, W. Dietz, O. Obermann. Z. anorg. allg. Chem., 249, 146 (1942).
- W. Fischer, G. Braune, W. Dietz, O. Obermann, G. Krause, К. E. Nieman, G. Siekemaier. Angew. Chem., 66, 317 (1954).
- W. Fischer, W. Harre, W. Freese, K. G. Haсksllein. Angew. Chem., 66, 165 (1954).
- W. Fischer et al. Naturforschung und Medizin in Dtschl., 1939; FIAT - Rev 23. 29 Wiesbaden (1949).
- W. Fischer. Angew. Chem., 55, 236 (1942).
- D. W. Appleton, W. Selwооd. J. Am. Chem. Soc., 63, 3251 (1941).
- C. C. Templeton, J. A. Peterson. J. Am. Chem. Soc., 71, 2187 (1949); 70, 3967 (1948).
- G. Asselin, F. Audrieth, E. W. Comings. J. Phys. Coll. Chem., 54, 640 (1950).
- R. Bock. Angew. Chem., 62, 378 (1950).
- J. Draganic. Rec. trav. inst. recherches structure matiere, 2, 73 (1953).
- W. Fischer, O. Steinhauser, E. Homan. Z. anal. Chem., 133, 57 (1951).
- W. Fischer, O. Obermann. Chem. Ind. Techn., 23, 298 (1951).
- Th. Moeller, D. E. Jackson. Anal. Chem., 22, 1993 (1950).
- J. С Warf. J. Am. Chem. Soc., 71, 3257 (1949).
- D. F. Peppard, J. P. Faris, P. R. Gray, G. W. Mason. J. Phys. Chem., 57, 294 (1953).
- R. H. Blackmore, A. E. Bearse, G. D. Chaikins. USAE Comm. BMI-261, 1952; цит. по C. A., 11773 (1956).
- H. E. Брежнева, В. И. Левин, Г. В. Корпусов, Н. М. Манько, Е. К. Богачева, Л. Т. Хорешко, Г. Ф. Платно в. Труды Второй международной конференции по мирному использованию атомной энергии. Женева, 1958. Доклады советских ученых. М., Атомиздат, 1958.
- Т. A. Butler, Е. Lamb, A. F. Рарp. Conf. an the Use Radioisotopes in the Phys Sci. and Ind., №-RICC/204. Copenhagen, 1961.
- L. Baybar, R. E. Leuse. CF-60-3-22, Contract N-7405-eng-26 OTS (1961); цит. no Nuclear Sci. Ab., 1578 (1960).
- J. Меnziеs, A. F. Вigbу. J. Appl. Chem., 11, 104 (1961).
- E. Hesfоr d, E. E. Jackson, H. A. C. Me Kay. J. Inorg. Nucl. Chem., 9 279 (1959) .
- D. F. Peppard, G. W. Masоn, W. J. Drisсоl, R. J. Sirоnen. J. Inorg. Nucl. Chem., 7, 276 (1958).
- D. F. Peppard W. J. Drisсоll, R. J. Sirоnen, Me Сarty. J. Inorg. Nucl. Chem., 4, 326 (1957).
- E. H. Патрушева, H. E. Брежнева, Г. В. Корпусов. Радиохимия, 2, 541. (1960) .
- В. И. Левин, Е. Н. Патрушева, Г. В. Корпусов, Л. Козырева. Сб.: "Методы получения и измерения радиоактивных препаратов". М., Атомиздат, 1960.
- Н. Е. Брежнева, В. И. Левин, Г. В. Корпусов, Е. Н. Патрушева. Радиохимия (в печати).
- D. Sсаrgill, К. Аlсосk, J. М. Fleeher, Е. Неsfоrd, Н. А. С. Мс К а у. J. Inorg. Nucl. Chem., 4, 304 (1957|).
- В. В. Фомин. П. Е. Картушова. Т. И. Руденко. ЖНХ, 3, 2117 (1958).
- В. Б. Шевченко, А. С. Соловкин, А. М. Кириллов, А. В. Родионов. Радиохимия, 3, 503 (1961).
- Е. Е. Крисс, 3. А. Шека. ЖНХ, 5, 2819 (1960).
- З. А. Шека, Е. Е. Крисс. Труды VIII Менделеевского съезда по общей химии. Секция неорганической химии и технологии. М., Изд-во АН СССР, 1959.
- З. А. Шека, Е. Е. Крисс. ЖНХ, 6, 1930 (1961).
- D. F. Рерраrd, P. R. Gray, М. М. Маrkus. J. Am. Chem. Soc., 75, 6069 (1953).
- J. Воshinski, M. Smutz, F. H. Spedding. Ind. Eng. Chem., 50, 157 (1958).
- L. L. Knapp, M. Smutz, F. H. Spedding. USAE ISC-706, Aug. (1956), цит. no Nuclear, Sci. Ab., 11111 (1957).
- J. Воshinski. Science, 29, 380 (1955).
- J. H. Воshinski. Abst. doct. thes. chem. Jowa state Coll. 1953-1954; цит. no РЖХим., № 4, 9556, 1956.
- D. F. Peppard, E. S. Naсhtman. U. S. Patent 2824783, Feb. 25 (1958).
- B. Weaver, F. А. Кappelmann, A. Tоpp. J. Am. Chem. Soc., 75, 3943 (1953); Сб.: "Редкоземельные элементы". М., ИЛ, 1957, стр. 254.
- В. Ержабек, А. К. Лаврухин а. ЖНХ, 3, 1703 (1958).
- А. В. Николаев, А. А. Сорокина. ДАН СССР, 129, 341 (1959).
- М. A. Welt, М. Smutz. U. S. Patent 2849286, Aug., 26, 1958; цит. no Nuclear, Sci. Ab.. 13, 4312 (1959).
- A. R. Fооs, H. F. Wilhelm. Цит. no Nuclear Sci. Ab., 8364 (1958).
- L. Imre. Z. anorg. allg. chem., 154, 214 (1927).
- R. Bock, E. Bock. Z. anorg. allg. Chem., 263, 146 (1950).
- J. C. Warf. U. S. Patent 2523892, 1949; 2564241, 1951.
- А. В. Николаев, А. А. Сорокина, А. С. Масленникова. ЖНХ, 3, 160 (1958).
- Г. В. Корпусов, В. И. Левин, Н. Е. Брежнева, Н. П. Прохорова, И. В. Ескевич, П. М. С ер еден ко. ЖНХ, 7, 2254 (1962).
- В. И. Левин, Г. В. Корпусов, Н. М. Манько, Е. Н. Патрушева, Н. П. Прохорова, Г. Ф. Платно в. Атомная энергия, 15, 148 (1963).
- В. В. Серебренников, М. А. Падалка, И. С. Левин. Уч. зап. Томского ун-та, Химия, 26 (1955).
- В. М. Клинаев, М. М. Сенявин. Сб.: "Применение меченых атомов в аналитической химии". М., Изд-во АН СССР, 1955, стр. 113.
- R. Bock, Е. Воск. Naturw., 36, 344 (1949).
- R. Воск, A. Mayer. Chem. angew. Techn., 25, 141 (1953).
- D. F. Peppard, G. W. Mason, S. W. Mоline. J. Inorg. Nucl. Chem., 5, 141 (1957).
- J. J. McCown, R. P. Larsen. Anal. Chem., 32, 597 (1960).
- E. Wesranоwski. Nucleonika, 5, 677 (1960).
- Я о Кэ-шень, Цзан Тао-ши, Чжун Хуань-вань. Scientia (24), 760 1957.
- С. П. Росян о в. Тр. Ленинградского технологич. ин-та им. Ленсовета, 55, 100 (1961) .
- Лян Шу-цюань, Е До-фо. Scientia (3), 87 (1958).
- J. W. Grider, R. W. Dоdsоn. J. Am. Chem. Soc., 71, 1894 (1949).
- E. Gluckauf. Ind. chim. Beige, 23, 2115 (1958).
- B. Sarma, P. D. Despande. J. Sci a. industr. Res., BC-79, 101В (1960).
- Г. В. Корпусов, И. В. Ескевич, Е. Н. Патрушева, В. В. Ерченков. Л. Р. Алексеева. Сб.: "Экстракция". М., Атомиздат, 1962, стр. 117.
- Е. Н. Патрушева, Н. Е. Брежнева, Г. В. Корпусов. Радиохимия (в печати).
- Г. В. Корпусов, И. В. Ескевич, Е. П. Жиров. Сб.: "Экстракция", вып. 1. М., Атомиздат, 1962, стр. 125.
- Г. К. Еремин, А. И. Каменев, Л. И. Мартыненко. ЖНХ, 6, 1487 (1961).
- В. А. Михайлов, В. Г. Торгов, Н. Ф. Мелехина. ЖНХ, 6, 1460 (1961).
- Г. В. Корпусов, В. Ф. Ескевич, Е. Н. Патрушева. Авторское свидетельство 135646, 1961.
- Г. В. Корпусов, Е. Н. Патрушева, В. Р. Соколова, Н. Н. Петракова. См. наст, сб., стр. 224.
- А. В. Николаев, А. А. Сорокина. ДАН СССР, 129, 341 (1959).
- S. Siekierski. J. Inorg. Nucl. Chem., 12, 129 (1959).
- В. В. Серебренников. Химия редкоземельных элементов, т. 2. Изд. Томск. ун-та, 1961.
- М. Г. Панова, Н. Е. Брежнева, В. И. Левин. Радиохимия, 2, 208 (1960).
- В. М. Щепалин, Г. В. Корпусов, Е. Н. Патрушева. ЖНХ (в печати).
- К. Б. Яцимирский, В. П. Васильев. Константы нестойкости комплексных соединений. М., Изд-во АН СССР, 1959.
- F. Н. Sped ding, S. Jaffе. J. Am. Chem. Soc., 76, 882 (1954).
- L. L. Вurger. J. Phys. Chem., 62, 590 (1958).
- М. Ф. Пушлeнков, Г. П. Никитина, В. Г. Воден. Радиохимия, 2, 215 (1969).
- D. F. Рерраrd, G. W. Мasоn, J. Hucher. J. Inorg. Nucl. Chem., 18, 245 (1961).
- T. A. Butler, E. E. Кetсhen. Ind. Eng. Chem., 53, 651 (1961).
- D. Dyrssen, L. D. Hay. Acta Chem. Scand., 14, 1100 (1960).
- З. А. Шека, E. E. Крисс. ЖНХ, 7, 658 (1962).
- D. Dyrssen. Svensk. kem. tidskr., 68, 212 (1956).
- R. A. Bolomey, L. Wish. J. Am. Chem. Soc., 72, 4483 (1950).
- W. B. Brown, J. F. Steibach, W. F. Wager. J. Inorg. Nucl. Chem., 13, 119 (1960).
- D. Dyrssen, D. Da hi berg. Acta Chem. Scand., 7, 1186 (1953).
- D. Dyrssen. Svensk. kem. tidskr., 66, 234 (1954).
- В. Hok - Вerstrom. Svensk. kem. tidskr., 68, 34 (1956).
- Y. G. Ishidaetal. Trans. Kentucky Acad. Sci., 21, 65 (1960).
- T. Ishimari. Bull. Chem. Soc. Japan, 28, 203 (1955).
- Т. C. Rains, H. P. House, О. Menis. Anal. chim. acta, 22, 315 (1960).
- J. Rydberg. Arkiv kemi, 9, 95 (1956).
- N. Suzuki, T. Kato. J. Chem. Soc. Japan, Pure Chem. Sec., 80, 1148 (1959).
- И. Стары, H. П. Pудeнко. ЖНХ, 4, 2405 (1959).
- Е. L. Smith, J. Е. Рagе. J. Chem. Soc. Ind., 67, 68 (1948).
- К. Колман, К. Браун, Д. Мур, К. Аллен. Вторая Международная конференция по мирному использованию атомной энергии. Избранные доклады иностранных ученых. Технология атомного сырья. М., Атомиздат, 1959, стр. 352.
- К. В. Brown, С. F. Coleman, D. J. Crouse, A. D. Ryon. Progress Report on Raw Materials for April, 1957; USAEC ORNL-2346, July, 9, 1957.
- F. L. Moore. Anal. Chem., 32, 1675 (1960); 33, 130 (1961).
- W. G. Grusinsky, G. T. Engel. Trans. Metal. Soc. of Aime, 215, 738 (1959).
- D. J. Сrоse, К. B. Brown. Contract N-7405-eng 26.
- Л. Альдере. Жидкостная экстракция. М., ИЛ, 1962.
- В. И. Левин. Сб.: "Экстракция", вып. 1. М., Атомиздат, 1962, стр. 143.
- А. М. Розен. Разделение изотопов в каскадных колоннах. М., Атомиздат, 1959.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'